Questão número 48408
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
A sacarose, composta por uma molécula de 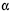 -D-glicose e uma de
-D-glicose e uma de 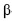 -D-frutose, tendo os átomos de carbono C1 da glicose e C2 da frutose participação na ligação glicosídica, é comumente conhecida como açúcar, sendo extraída para distribuição comercial da cana-de-açúcar (Sacharum officinarum) e da beterraba (Beta vulgaris). No estômago de mamíferos, a sacarose é digerida por hidrólise ácida, que é o mesmo processo usado, em laboratório, para se obterem glicose e frutose. Estas, resultantes da hidrólise da sacarose, são rapidamente absorvidas no intestino delgado, penetrando na corrente sanguínea. Por esses motivos, a sacarose é uma fonte de energia química rápida (com um conteúdo calórico de 17 kJ/g) e causa, logo após sua ingestão, a subida dos níveis sanguíneos de glicose. A partir do gráfico a seguir (ln k × 1/T), em que k representa a constante de velocidade da reação e T, a temperatura absoluta, é possível determinar um dos parâmetros de Arrhenius, isto é, a energia de ativação, Ea , para a hidrólise ácida da sacarose. Considere-se que a velocidade da reação dependa exclusivamente da concentração de sacarose e observe-se que dois pontos da reta são mostrados no gráfico.
-D-frutose, tendo os átomos de carbono C1 da glicose e C2 da frutose participação na ligação glicosídica, é comumente conhecida como açúcar, sendo extraída para distribuição comercial da cana-de-açúcar (Sacharum officinarum) e da beterraba (Beta vulgaris). No estômago de mamíferos, a sacarose é digerida por hidrólise ácida, que é o mesmo processo usado, em laboratório, para se obterem glicose e frutose. Estas, resultantes da hidrólise da sacarose, são rapidamente absorvidas no intestino delgado, penetrando na corrente sanguínea. Por esses motivos, a sacarose é uma fonte de energia química rápida (com um conteúdo calórico de 17 kJ/g) e causa, logo após sua ingestão, a subida dos níveis sanguíneos de glicose. A partir do gráfico a seguir (ln k × 1/T), em que k representa a constante de velocidade da reação e T, a temperatura absoluta, é possível determinar um dos parâmetros de Arrhenius, isto é, a energia de ativação, Ea , para a hidrólise ácida da sacarose. Considere-se que a velocidade da reação dependa exclusivamente da concentração de sacarose e observe-se que dois pontos da reta são mostrados no gráfico.
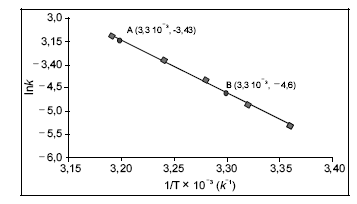
Considerando-se que a constante universal dos gases vale 8,3145 J·K-1· mol-1 , é correto concluir que o valor da energia de ativação da hidrólise ácida da sacarose é
- A.
inferior a 80 kJ/mol.
- B.
superior ou igual a 80 kJ/mol e inferior a 90 kJ/mol.
- C.
superior ou igual a 90 kJ/mol e inferior a 100 kJ/mol.
- D.
superior 100 kJ/mol.


