Questão número 49557
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
A crescente preocupação mundial com o esgotamento das reservas petrolíferas tem gerado um grande número de pesquisas para a obtenção de energia a partir de outras fontes. Uma dessas alternativas, que está em desenvolvimento, é a utilização de hidrogênio gerado a partir da oxidação do metano, segundo a equação química a seguir.
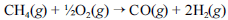
Na tabela a seguir, são fornecidas as entalpias de formação do metano e do monóxido de carbono.

A partir dessas informações, julgue os itens seguintes.
Considerando-se que, à temperatura de 1.300 K e a 1 atm, a entalpia da reação apresentada seja igual a -22 kJ, então é correto concluir que, quanto maior a temperatura, maior é o calor liberado por essa reação, mantida a pressão constante.
- C. Certo
- E. Errado


