Questão número 541977
A Equação de Estado de van der Waals, 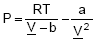 foi a primeira a predizer com relativo sucesso o equilíbrio transição líquido–vapor de substâncias puras. Sabendo que os coeficientes "a" e "b" são específicos para cada substância e não são dependentes nem da temperatura nem da pressão.
foi a primeira a predizer com relativo sucesso o equilíbrio transição líquido–vapor de substâncias puras. Sabendo que os coeficientes "a" e "b" são específicos para cada substância e não são dependentes nem da temperatura nem da pressão.
I. O coeficiente "b" da equação para uma dada substância, representa o menor volume possível que um mol desta substância pode assumir.
II. Em baixas temperaturas e altas pressões o resultado obtido através da equação de van der Waals para o volume molar tende a ser muito próximo do resultado obtido (para o volume molar) utilizando-se a equação dos gases ideais.
III. O termo (− a/V2) é o termo que leva em consideração as forças de atração entre as moléculas das substâncias puras.
IV. Esta é uma equação cúbica em V, em temperaturas abaixo da crítica, para uma mesma pressão de vapor a dada temperatura tem-se três raízes, a menor é o volume molar do líquido, a maior é o volume molar do vapor e a intermediária não tem sentido físico.
V. Para volumes molares muito grandes os resultado apresentados por esta equação tendem aos resultado obtidos pela equação dos gases ideais, em uma mesma temperatura.
É correto o que se afirma APENAS em
- A.
II e V.
- B.
I, IV, e V.
- C.
II, III, e V.
- D.
I, II, III, e IV.
- E.
I, III, IV e V.


