Questão número 543057
A figura seguinte ilustra, em um diagrama de pressão versus volume, a expansão isotérmica reversível de um mol de um gás ideal, desde um estado inicial A, correspondente a uma pressão de 300 kPa e um volume de 8,00 L, até um estado final B, com pressão e volume iguais a 100 kPa e 20,00 L, respectivamente.
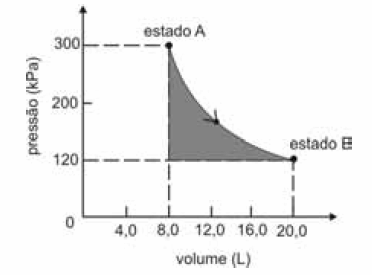
Com base nessas informações e considerando que a constante universal dos gases, R, seja igual a 8,3 .J.mol -1 K -1 e que os logaritmos naturais de 5 e 2 sejam iguais a 1,609 e 0,693, respectivamente, julgue os itens a seguir.
O calor, q, que entra para o sistema a partir das vizinhanças durante a transformação em questão é maior que o produto nRT, em que n e T representam, respectivamente, a quantidade de matéria e a temperatura do gás.
- C. Certo
- E. Errado


