Questões de Engenharia Química
Lista completa de Questões de Engenharia Química para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
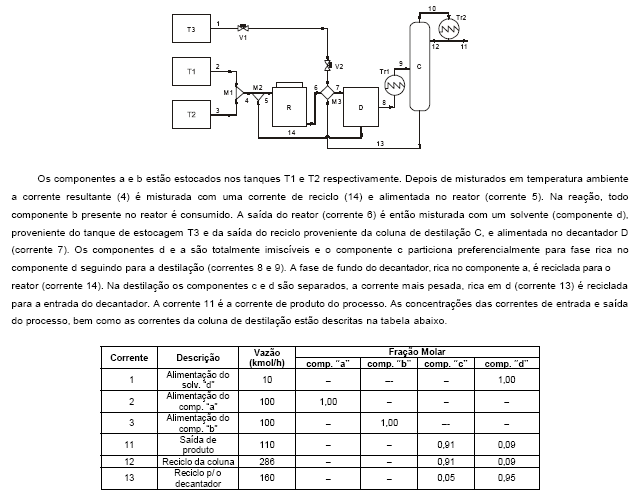
Atenção: Para responder as questões de números 61 a 70 considere o enunciado, a figura e a tabela abaixo. Você acabou de ser contratado para dar continuidade ao desenvolvimento e implantação de um processo em uma grande indústria química. O processo será basicamente a produção do composto c a partir da reação dos componentes a e b, subprodutos desta indústria. A reação entre a e b, que possuem mesma massa molecular , é uma reação endotérmica e ocorre em fase líquida a 24 °C, obedecendo a seguinte estequiometria:
a + b → c ΔHreação = 40 kJ/(kg de c formado)
O diagrama do processo a ser implantado está representado abaixo.

O reator R é um tanque aquecido e supostamente agitado perfeitamente. Se a reação de formação de "c" deve ocorrer a 24 °C é irreversível e tem grau de avanço igual a 1; calcule a taxa de energia a ser fornecida para que a temperatura de saída se mantenha em 24 °C, quando a alimentação tem uma vazão de 360 kg/h e é uma corrente equimolar dos componentes "a" e "b", mantida a 20 °C. Despreze a energia transferida através das pás do agitador.
- A.
22.752 kJ/h
- B.
20.448 kJ/h
- C.
14.400 kJ/h
- D.
13.248 kJ/h
- E.
8.352 kJ/h
Atenção: Para responder as questões de números 61 a 70 considere o enunciado, a figura e a tabela abaixo. Você acabou de ser contratado para dar continuidade ao desenvolvimento e implantação de um processo em uma grande indústria química. O processo será basicamente a produção do composto c a partir da reação dos componentes a e b, subprodutos desta indústria. A reação entre a e b, que possuem mesma massa molecular , é uma reação endotérmica e ocorre em fase líquida a 24 °C, obedecendo a seguinte estequiometria:
a + b → c ΔHreação = 40 kJ/(kg de c formado)
O diagrama do processo a ser implantado está representado abaixo.
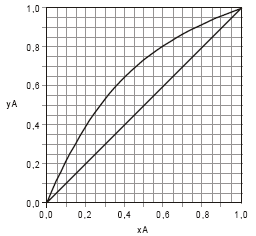
A figura abaixo apresenta o equilíbrio líquido-vapor entre os componentes "c" e "d". calcule o número de estágios teóricos da coluna C para obter os produtos de topo (corrente 11) e de fundo (corrente 13) requeridos no projeto, utilizando o método gráfico de McCabe e Thiele. Nesta operação deverá ser utilizada uma taxa de refluxo de 2,6 mol (corrente 12) para cada mol produzido no topo (corrente 11).
- A.
4
- B.
Entre 5 e 6.
- C.
Entre 7 e 9.
- D.
Entre 11 e 12.
- E.
Entre 13 e 16.
Atenção: Para responder as questões de números 61 a 70 considere o enunciado, a figura e a tabela abaixo. Você acabou de ser contratado para dar continuidade ao desenvolvimento e implantação de um processo em uma grande indústria química. O processo será basicamente a produção do composto c a partir da reação dos componentes a e b, subprodutos desta indústria. A reação entre a e b, que possuem mesma massa molecular , é uma reação endotérmica e ocorre em fase líquida a 24 °C, obedecendo a seguinte estequiometria:
a + b → c ΔHreação = 40 kJ/(kg de c formado)
O diagrama do processo a ser implantado está representado abaixo.
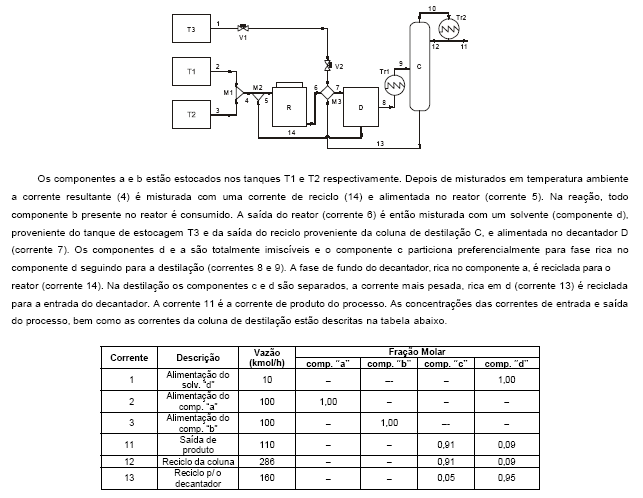
O sistema de controle abaixo representa um pedaço da malha de controle que será utilizado na coluna C. Para que haja estabilidade neste sistema, o intervalo de valores para o coeficiente K (ganho proporcional) deve ser:

- A.
0 < K < 8/9.
- B.
−8/9 < K < 8/9.
- C.
0 < K < 14/9.
- D.
−14/9 < K < 14/9.
- E.
−14/9 < K < 8/9.
Atenção: Para responder as questões de números 61 a 70 considere o enunciado, a figura e a tabela abaixo. Você acabou de ser contratado para dar continuidade ao desenvolvimento e implantação de um processo em uma grande indústria química. O processo será basicamente a produção do composto c a partir da reação dos componentes a e b, subprodutos desta indústria. A reação entre a e b, que possuem mesma massa molecular , é uma reação endotérmica e ocorre em fase líquida a 24 °C, obedecendo a seguinte estequiometria:
a + b → c ΔHreação = 40 kJ/(kg de c formado)
O diagrama do processo a ser implantado está representado abaixo.

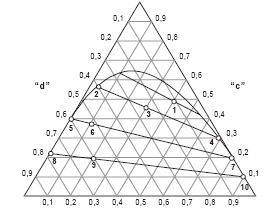
Dos pontos (1−10) representados no diagrama de equilíbrio líquido-líquido entre os componentes "a", "c" e "d", em ter-mos de frações molares, quais representam a alimentação no decantador "D" (corrente 7), a saída da fase leve do decantador (corrente 8) e o reciclo do reator (fase pesada do decantador, corrente 14) respectivamente?
- A.
Pontos 3, 4 e 2.
- B.
Pontos 3, 4 e 2.
- C.
Pontos 9, 8 e 10.
- D.
Pontos 1, 7 e 5.
- E.
Pontos 6, 5 e 7.
Para o combate de fogos de grandes dimensões que envolvam locais de armazenagem de líquidos combustíveis, de combustão anaeróbica, deve-se optar pelo sistema de
- A. chuveiros automáticos.
- B. espuma.
- C. hidrantes.
- D. CO2.
- E. proteção por extintores.
Sobre o processo de detonação de explosivos, é correto afirmar:
- A.
É uma transformação física ou química rápida acompanhada da conversão da energia potencial em trabalho mecânico.
- B.
É uma propagação supersônica auto-sustentada de uma reação de decomposição química exotérmica.
- C.
É uma transformação de energia cinética em trabalho de expansão isobárica.
- D.
É uma reação de oxi-redução que absorve energia, produzindo trabalho de descompressão isotérmica.
- E.
É uma mudança de fase do estado gasoso para o estado líquido.
As cetonas formam uma classe de compostos orgânicos que contêm um grupo carbonila cujo átomo de carbono se liga apenas aos grupos alquila, alquenila, acila e/ou arila. Dentre os métodos de análise para as determinações quantitativa e qualitativa de cetonas, é correto empregar:
- A.
cromatografia líquida com detector UV e absorbância 524 nm.
- B.
espectroscopia infravermelha, com a freqüência de alongamento C = O no espectro caracterizada por um forte pico em 1720 cm-1
- C.
cromatografia em camada delgada.
- D.
eletroforese.
- E.
análise do ponto de ebulição e ponto de fulgor.
Explosivos iniciadores:
- A.
são empregados para iniciar a pressurização da carga explosiva.
- B.
são usados para projeção ou propulsão.
- C.
são constituídos por substâncias quimicamente puras.
- D.
apresentam velocidade de decomposição compreendida entre 6 e 400 m/s.
- E.
são estáveis ao armazenamento.
Considere as seguintes afirmativas:
- A.
As afirmativas 1, 2, 3 e 4 são verdadeiras.
- B.
Somente a afirmativa 1 é verdadeira.
- C.
Somente as afirmativas 1, 2 e 4 são verdadeiras.
- D.
Somente as afirmativas 2 e 3 são verdadeiras.
- E.
Somente as afirmativas 2, 3 e 4 são verdadeiras.
A decomposição do carbonato de cálcio ocorre na temperatura de 973,15 K e à pressão constante de 1 atmosfera, formando 1 mol de óxido de cálcio e 1 mol de dióxido de carbono a partir de 1 mol de carbonato de cálcio. Considerando que o dióxido de carbono se comporte como um gás ideal, calcule o trabalho realizado durante o processo.
- A.
–8094 kJ
- B.
8094 kJ
- C.
–8,094 kJ
- D.
8,094 kJ
- E.
–809,4 kJ


