Questões de Engenharia Química
Lista completa de Questões de Engenharia Química para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Acerca dos métodos espectroscópicos de análise, de potenciometria e volumetria, julgue os itens que se seguem.
Uma das diferenças básicas entre a espectroscopia de absorção molecular no infravermelho e a espectroscopia de absorção molecular no ultravioleta é que no primeiro caso estão envolvidas transições entre níveis eletrônicos e, no segundo caso, as transições envolvem níveis vibracionais.
- C. Certo
- E. Errado
Acerca dos métodos espectroscópicos de análise, de potenciometria e volumetria, julgue os itens que se seguem.
Os métodos potenciométricos envolvem, necessariamente, reações de oxidação e redução, devido à presença dos eletrodos em solução.
- C. Certo
- E. Errado
Acerca dos métodos espectroscópicos de análise, de potenciometria e volumetria, julgue os itens que se seguem.
Por apresentarem os mesmos padrões de acoplamento no espectro de hidrogênio, os compostos CH3OCH3 e CH3COCH3 não podem ser diferenciados por ressonância magnética nuclear.
- C. Certo
- E. Errado
Acerca dos métodos espectroscópicos de análise, de potenciometria e volumetria, julgue os itens que se seguem.
A espectroscopia de ultravioleta não permite análises quantitativas das amostras.
- C. Certo
- E. Errado
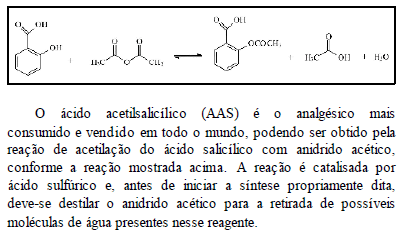
Considerando essas informações, julgue os itens subseqüentes.
A presença de água diminui o rendimento da reação, daí a necessidade de se destilar o anidrido acético.
- C. Certo
- E. Errado
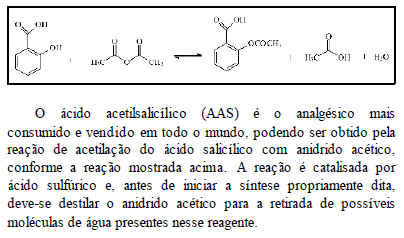
Considerando essas informações, julgue os itens subseqüentes.
O mecanismo da reação é o mesmo com ou sem catalisador. Apenas a energia de ativação é alterada.
- C. Certo
- E. Errado
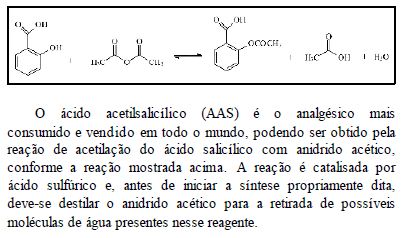
Considerando essas informações, julgue os itens subseqüentes.
O ácido sulfúrico aumenta a energia de ativação e, conseqüentemente, torna a reação mais rápida.
- C. Certo
- E. Errado
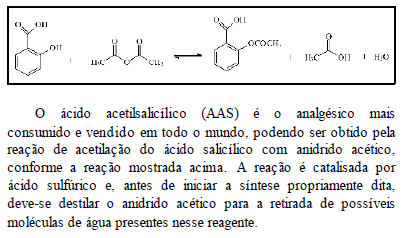
Considerando essas informações, julgue os itens subseqüentes.
Sabendo que a reação mencionada é endotérmica, é correto afirmar que o aquecimento do meio reacional favorece a formação de AAS.
- C. Certo
- E. Errado
Considere as seguintes situações.
I: estado inicial é gelo a 0ºC; estado final é água pura a 0ºC
II: água pura a 100ºC
Considerando esses sistemas, julgue os itens que se seguem.
Na situação I, o processo é endotérmico.
- C. Certo
- E. Errado
Considere as seguintes situações.
I: estado inicial é gelo a 0ºC; estado final é água pura a 0ºC
II: água pura a 100ºC
Considerando esses sistemas, julgue os itens que se seguem.
Para o processo na situação I, é correto afirmar que a variação de entalpia é menor que o produto da variação de entropia pela temperatura em Kelvin.
- C. Certo
- E. Errado


