Questões de Engenharia Química
Lista completa de Questões de Engenharia Química para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
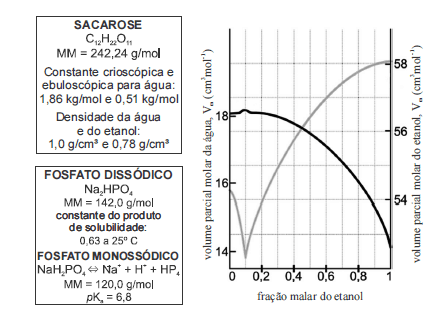
Considerando as informações fornecidas nos quadros e no gráfico acima, julgue os itens que se seguem.
O pH de uma solução 0,2 M de fosfato monossódico, que contenha 99 mL, se reduz pela adição de 0,5 mL de ácido clorídrico 0,1 M.- C. Certo
- E. Errado
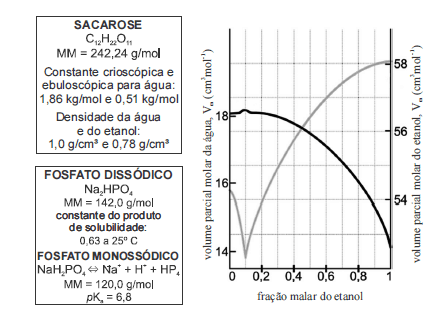
Considerando as informações fornecidas nos quadros e no gráfico acima, julgue os itens que se seguem.
O valor do pOH de uma solução de fosfato monossódico é reduzido com a adição de cloreto de sódio.- C. Certo
- E. Errado
Acerca do preparo de soluções, julgue os próximos itens. A molaridade expressa a concentração de soluções e é dependente da temperatura, enquanto a molalidade, também utilizada para isso, não é influenciada por essa variável.
- C. Certo
- E. Errado
Tomando o valor da constante universal dos gases igual a 8,3145 kPa L K-1 mol 1, julgue os itens seguintes, relativos a propriedades dos gases. Considere que a média das massas molares dos gases que compõem a atmosfera de um determinado planeta seja igual a 30 g/mol. Nesse planeta, uma bola de encher que contenha CO2 subiria se fosse solta no ar.
- C. Certo
- E. Errado
Tomando o valor da constante universal dos gases igual a 8,3145 kPa L K-1 mol 1, julgue os itens seguintes, relativos a propriedades dos gases. A pressão exercida por 2,0 g de nitrogênio gasoso a 20 ºC em um recipiente de um litro e temperatura de 20 ºC tem valor entre 172,00 e 173,00 kPa.
- C. Certo
- E. Errado
Tomando o valor da constante universal dos gases igual a 8,3145 kPa L K-1 mol 1, julgue os itens seguintes, relativos a propriedades dos gases. Segundo o modelo cinético dos gases, as moléculas em um gás não interagem umas com as outras, exceto quando colidem; desse modo, a energia potencial é independente da distância entre as moléculas e pode ser considerada zero. Assim, pode-se afirmar que a energia total do sistema depende da velocidade das moléculas.
- C. Certo
- E. Errado
Tomando o valor da constante universal dos gases igual a 8,3145 kPa L K-1 mol 1, julgue os itens seguintes, relativos a propriedades dos gases. Considere que um mol de hidrogênio e um mol de nitrogênio gasoso passam por um pequeno orifício em condições de temperatura e pressão constantes. Nessas condições, a razão entre as velocidades de efusão do hidrogênio em relação ao nitrogênio é de aproximadamente 14 vezes.
- C. Certo
- E. Errado
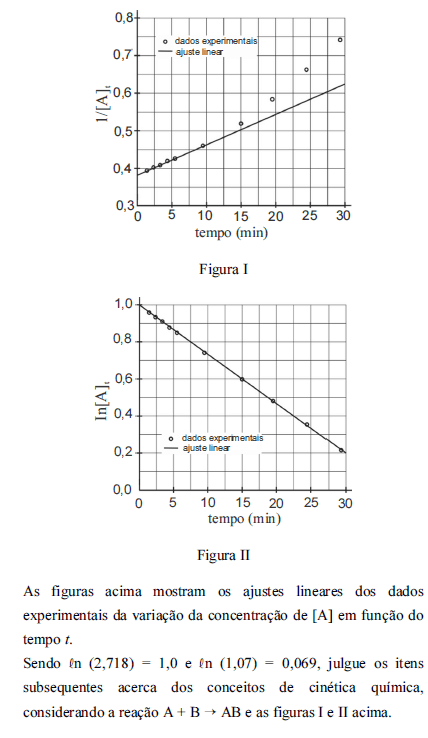 Caso a reação ocorresse na presença de um catalisador ou com a pressão aumentada, a concentração de [A] em t = 35 min seria maior que 1,5 mol L-1.
Caso a reação ocorresse na presença de um catalisador ou com a pressão aumentada, a concentração de [A] em t = 35 min seria maior que 1,5 mol L-1.
- C. Certo
- E. Errado
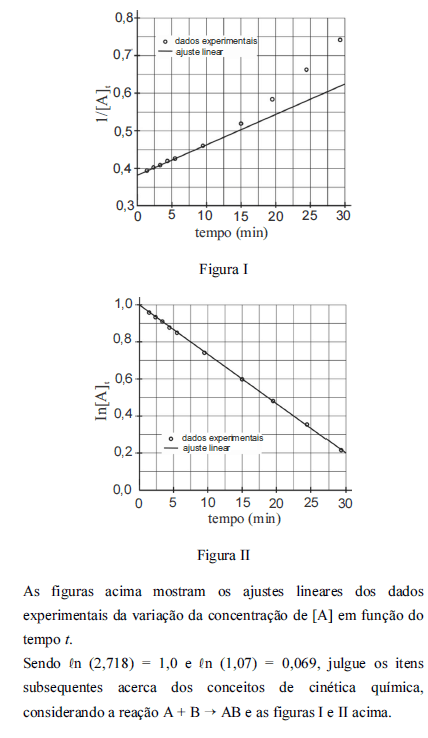 A partir dos ajustes lineares da variação da concentração de [A] em função do tempo t, a velocidade de consumo de [A] na reação geral I corresponde a uma cinética de segunda ordem.
A partir dos ajustes lineares da variação da concentração de [A] em função do tempo t, a velocidade de consumo de [A] na reação geral I corresponde a uma cinética de segunda ordem.
- C. Certo
- E. Errado
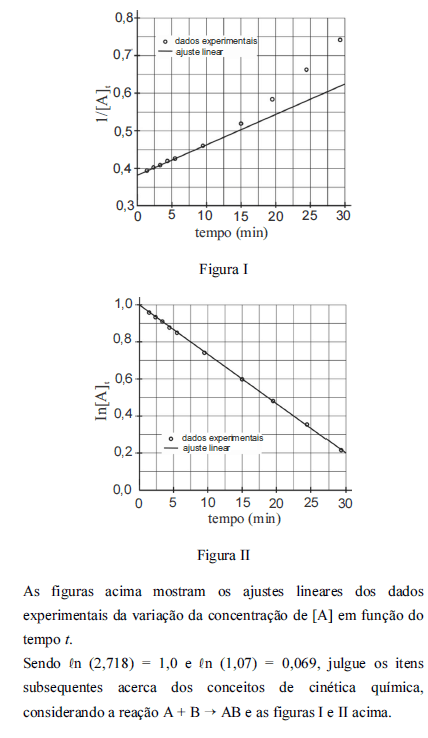 O valor da constante de velocidade na equação de velocidade da reação é 2,66 x 10-2.
O valor da constante de velocidade na equação de velocidade da reação é 2,66 x 10-2.
- C. Certo
- E. Errado


