Questões de Engenharia Química
Lista completa de Questões de Engenharia Química para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
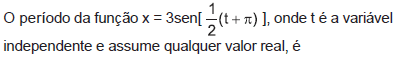
- A.

- B.
4
- C.

- D.

- E.

Colocando-se, aleatoriamente, as nove letras da palavra PETROBRAS em fila, a probabilidade de que as duas letras R fiquem juntas é
- A.

- B.

- C.

- D.

- E.

A distância focal da elipse de equação 3x2 + 4y2 = 36 é
- A.
6
- B.
4
- C.

- D.

- E.


- A.
872
- B.
872
- C.
24
- D.
24
- E.
9

- A.
III, apenas.
- B.
I e II, apenas.
- C.
I e III, apenas.
- D.
II e III, apenas.
- E.
I, II e III.
Considere o quadro a seguir:

Nesse quadro, foram deixadas lacunas indicadas pelos algarismos I, II, III, IV e V. A alternativa que apresenta um preenchimento INCORRETO da lacuna é:
- A.
I metálico.
- B.
II átomos.
- C.
III baixa.
- D.
IV naftaleno, iodo e gelo seco.
- E.
V carborundum e carbeto de tungstênio.
O sulfato cúprico pode ser utilizado na alimentação animal e como fonte dos nutrientes Cu e S para a nutrição das plantas. Esse sal pode ser obtido pela reação entre o óxido de cobre II e o ácido sulfúrico. Considerando que a reação referida anteriormente ocorra com 100% de rendimento, para um sistema contendo 10 mols de óxido cúprico e 1,3 kg de ácido sulfúrico, pode-se afirmar que: (Dados: Massas molares (g/mol) => Cu = 63,5 g mol1; S = 32,0 g mol1; O = 16,0 g mol1; H = 1,0 g mol1)
- A.
A adição de maior quantidade de H2SO4 ao sistema aumenta a massa de CuSO4 formada.
- B.
A quantidade de CuSO4 formada será inferior a 2,0 kg.
- C.
A quantidade de matéria de CuSO4, no final da reação, será igual à quantidade de matéria de H2SO4 no início da reação.
- D.
A solução resultante será neutra após a reação ter-se completado.
- E.
O sistema contém CuO após a reação ter-se completado.
A partir de 1982, a União Internacional de Química Pura e Aplicada (IUPAC) alterou o valor da pressão padrão, de forma que as novas Condições Normais de Temperatura e Pressão (CNTPs) passaram a ser:

- A.
22,4
- B.
30,2
- C.
22,7
- D.
0,0224
- E.
0,0227
Em um recipiente contendo 1,08 g de cloreto de bário diidratado foi adicionado excesso de solução de nitrato de prata. Em seguida, o precipitado obtido foi filtrado e seco em estufa. Considere que o processo foi realizado com 100% de rendimento. (Dados: Massas molares (g/mol) => Ba = 137,00, Cl = 35,50, Ag = 108,00, H = 1,00, O = 16,00) Marque a alternativa em que o valor mais se aproxima da massa (em g) do precipitado obtido:
- A.
1,26
- B.
2,32
- C.
1,63
- D.
2,20
- E.
1,47
Num balão de vidro (1,00 L) a 25ºC hermeticamente fechado e pressão de 1 atm, foram adicionadas quantidades equimolares de hidrogênio gasoso e de vapor de iodo. Para esse sistema, a equação da velocidade (v) da reação elementar de formação do iodeto de hidrogênio deve ser escrita da seguinte forma:
- A.
(k1/k2) [H2] ([I2]/[HI]2) mol/L.s
- B.
k1 [H2] [I2] mol/L.s
- C.
k [HI]2 / ([H2] [I2]) mol/L.s
- D.
k1 [H2]2 [I2]0 mol/L.s
- E.
[HI]2 / ([H2] [I2]) mol/L.s


