Questões de Engenharia Química do ano 2007
Lista completa de Questões de Engenharia Química do ano 2007 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
A figura abaixo descreve um sistema do tipo cilindropistão. Considere que não existe atrito entre o pistão e a parede do cilindro. Inicialmente a pressão no interior do cilindro é de 2 . 105 Pa e a temperatura é 300 K. Calcule o trabalho necessário, por mol de gás no interior do cilindro, para que o sistema atinja a nova condição de equilíbrio após a retirada do pino "A". Considere também que o processo é isotérmico e que a pressão externa é a atmosférica (1 . 105 Pa).
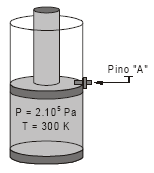
- A.
−2494,2 J/mol
- B.
−1728,8 J/mol
- C.
−1247,1 J/mol
- D.
1728,8 J/mol
- E.
2494,2 J/mol
Uma turbina é alimentada com vapor superaquecido a 600 °C e 8 atm. A corrente de alimentação tem uma velocidade de 80 m/s e vazão mássica de 4,0 kg/s. A corrente de saída tem velocidade de 20 m/s, temperatura de 300 °C e pressão 1 atm. Se o equipamento opera em regime de estado estacionário, qual a máxima quantidade de trabalho possível de se extrair desta turbina?
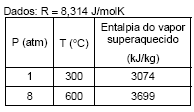
- A.
2500,0 kJ/s.
- B.
2512,0 kJ/s.
- C.
2506,0 kJ/s.
- D.
2514,4 kJ/s.
- E.
2524,0 kJ/s.
Determine a pressão de bolha (Pbolha) de uma mistura líquida contendo 20% de pentano, 50% hexano e 30% de heptano (em composição molar) e a fração molar de pentano (yp) na fase vapor em equilíbrio com esta mistura líquida mantida a 60 °C. Nesta temperatura, as pressões de vapor do pentano, hexano e heptano são, respectivamente, 2,9; 1,1 e 0,4 bar.
- A.
Pbolha = 1,25; yp = 0,464.
- B.
Pbolha = 1,79; yp = 0,810.
- C.
Pbolha = 1,79; yp = 0,780.
- D.
Pbolha = 1,25; yp = 0,522.
- E.
Pbolha = 1,79; yp = 0,580.
Considere as afirmativas e a figura abaixo, que representa o diagrama de fases para uma substância pura.
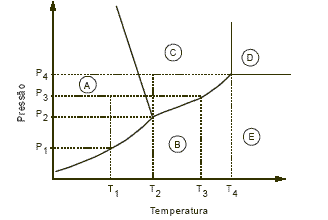
I. As regiões A, D e E representam regiões em que a substância seria um sólido, um fluido-supercrítico e um gás, respectivamente.
II. A temperatura e a pressão do ponto triplo desta substância são T4 e P4.
III. Se esta substância estiver inicialmente na temperatura e na pressão T1 e P3, ao elevar-se a temperatura até T2, mantendo a pressão constante, mudase o estado de agregação da substância de sólido para líquido.
IV. A pressão P1 é a pressão de liquefação na temperatura T1, para esta substância.
V. A temperatura T3 é a temperatura de ebulição desta substância na pressão P3.
É correto o que se afirma APENAS em
- A.
III, IV e V.
- B.
II, III e V.
- C.
I, II e IV.
- D.
I, III e V.
- E.
II e V.
Um grupo de pesquisadores mediu a variação da pressão de vapor do Argônio com a temperatura na vizinhança de 84 K e determinou a seguinte correlação: T B lnPvap = A − B/T ; sendo A = 22,5 e B = 995,2 K. Determine a variação de entropia na mudança de fase (líquido-vapor) do argônio a 84 K.
Dados:
(R = 8,314 J/molK)
- A.
2,2 J/molK.
- B.
31,0 J/molK.
- C.
98,5 J/molK.
- D.
15,7.102 J.K/mol.
- E.
69,5.104 J.K/mol.
A Equação de Estado de van der Waals, 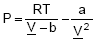 foi a primeira a predizer com relativo sucesso o equilíbrio transição líquido–vapor de substâncias puras. Sabendo que os coeficientes "a" e "b" são específicos para cada substância e não são dependentes nem da temperatura nem da pressão.
foi a primeira a predizer com relativo sucesso o equilíbrio transição líquido–vapor de substâncias puras. Sabendo que os coeficientes "a" e "b" são específicos para cada substância e não são dependentes nem da temperatura nem da pressão.
I. O coeficiente "b" da equação para uma dada substância, representa o menor volume possível que um mol desta substância pode assumir.
II. Em baixas temperaturas e altas pressões o resultado obtido através da equação de van der Waals para o volume molar tende a ser muito próximo do resultado obtido (para o volume molar) utilizando-se a equação dos gases ideais.
III. O termo (− a/V2) é o termo que leva em consideração as forças de atração entre as moléculas das substâncias puras.
IV. Esta é uma equação cúbica em V, em temperaturas abaixo da crítica, para uma mesma pressão de vapor a dada temperatura tem-se três raízes, a menor é o volume molar do líquido, a maior é o volume molar do vapor e a intermediária não tem sentido físico.
V. Para volumes molares muito grandes os resultado apresentados por esta equação tendem aos resultado obtidos pela equação dos gases ideais, em uma mesma temperatura.
É correto o que se afirma APENAS em
- A.
II e V.
- B.
I, IV, e V.
- C.
II, III, e V.
- D.
I, II, III, e IV.
- E.
I, III, IV e V.
Em uma tubulação, com duas seções A e B de diâmetros diferentes, escoa água com vazão volumétrica igual a 0,942 L/s. Se as seções A e B possuem, respectivamente, diâmetros de 2 e 4 cm, determine a redução de velocidade da água, em m/s, entre as seções A e B.
- A.
0,57 m/s.
- B.
0,75 m/s.
- C.
1,50 m/s.
- D.
2,00 m/s.
- E.
2,25 m/s.
Em um escoamento laminar plenamente desenvolvido que obedece ao seguinte perfil de velocidades: 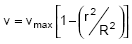 , a vazão média é de 1,256.10-3 m3/s. Sabendo que o raio da tubulação é R = 2 cm, determine a velocidade para a camada de escoamento onde r = 0,5 R.
, a vazão média é de 1,256.10-3 m3/s. Sabendo que o raio da tubulação é R = 2 cm, determine a velocidade para a camada de escoamento onde r = 0,5 R.
- A.
2,00 m/s.
- B.
1,75 m/s.
- C.
1,00 m/s.
- D.
1,50 m/s.
- E.
0,75 m/s.
Dos números adimensionais abaixo, o único que relaciona fluxo convectivo de calor com fluxo condutivo de calor é o:
- A.
Reynolds, Re.
- B.
Nusselt, Nu.
- C.
Froude, Fr.
- D. Fator de Darcy, D.
- E.
Fator de Fanning, .
Em um projeto, a parede de um forno deverá ser construída com duas camadas de materiais diferentes e um espaço contendo ar estagnado (k = 0,02 kcal/(h)(m2)(°C/m)) entre estas camadas. A camada interna deverá ser feita de tijolos refratários com espessura de 10 cm (k = 0,10 kcal/(h)(m2)(oC/m)); a camada externa de tijolos de alvenaria com 15 cm de espessura (k = 0,30 kcal/(h)(m2)(°C/m)). O projeto prevê uma perda de calor de no máximo 300 kcal/m2h e que a temperatura externa não ultrapasse 80 °C. Calcule a espessura mínima da camada de ar para que o projeto se adeqüe as especificações desejadas, sabendo que o forno operará a 800 °C.
- A.
1,8 cm.
- B.
2,3 cm.
- C.
8,2 cm.
- D.
18,0 cm.
- E.
23,0 cm.


