Questões de Engenharia Química do ano 2008
Lista completa de Questões de Engenharia Química do ano 2008 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
A análise de 250 mL de uma amostra de água contaminada com HCl acusou pH = 4. A quantidade máxima de CaCO3 (s), em gramas, que pode reagir com essa amostra, segundo a equação
CaCO3 (s) + H+ (aq) Ca2+ (aq) + HCO _ 3 (aq)
é, aproximadamente
Dado: massa molar (g/mol) CaCO3 = 100
- A.
2,5 × 10−5
- B.
1,0 × 10−4
- C.
2,5 × 10−3
- D.
2,5 × 10−2
- E.
1,0 × 10−1
Na análise de fósforo em águas naturais utiliza-se o método espectrofotométrico do Azul de Molibdênio. Para amostras muito diluídas recomenda-se, no sentido de melhorar a sensibilidade do método,
I. o aumento do caminho óptico.
II. a utilização do comprimento de onda auxiliar.
III. a utilização do método da adição de padrão.
Está correto o que se afirma APENAS em
- A.
I.
- B.
II.
- C.
III.
- D.
I e II.
- E.
I e III.
Na reação global que ocorre numa bateria de automóvel, conforme a equação
Pb (s) + PbO2 (s) + 2H2SO4 (aq) 2PbSO4 (s) + 2H2O (l)
o número de elétrons transferidos de 1 mol de átomos Pb (s) para PbO2 (s)
é, aproximadamente,Dado:
Constante de Avogadro: 6,0 × 1023
- A.
6,0 × 1023
- B.
1,2 × 1024
- C.
1,8 × 1024
- D.
2,4 × 1024
- E.
3,0 × 1024
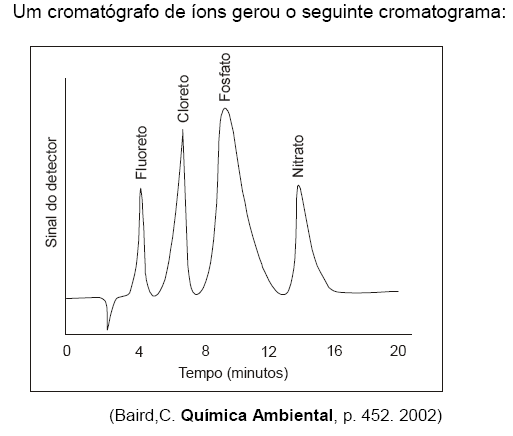
As informações obtidas permitem concluir que
I. a concentração do íon fosfato é diretamente proporcional à altura do pico.
II. o íon de maior afinidade com a fase móvel é o fluoreto.
III. o íon nitrato possui maior tempo de retenção. Está correto o que se afirma em
- A.
I, II e III.
- B.
I e II, apenas.
- C.
II, apenas.
- D.
III, apenas.
- E.
II e III, apenas.
Abaixo está representado um espectro de 1H-RNM de uma bebida alcoólica que contém 40% de etanol e água.
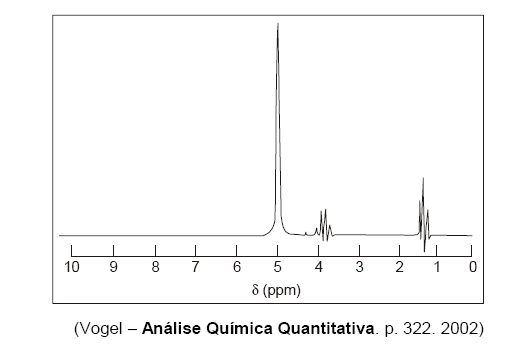
Sabendo-se que os outros componentes da bebida estão em concentrações inferiores ao limite de detecção da técnica, o sinal em 5,0 ppm indica
- A.
os grupos CH2 e CH3 do etanol.
- B.
os grupos OH da água e do etanol.
- C.
o grupo CH2 do etanol.
- D.
o grupo CH3 do etanol.
- E.
o grupo CC do etanol.
Um técnico de laboratório preparou um litro das seguintes soluções:
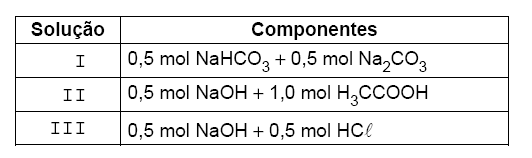
Dessas soluções, apresenta propriedade tampão APENAS
Dados: constantes de dissociação (a 20 °C) H2CO3: k1 = 1,5 × 10−7 k2 = 7,0 × 10−11 NaOH = 4,0 H3CCOOH = 1,6 × 10−5 HCl = 107
- A.
I.
- B.
II.
- C.
III.
- D.
I e II.
- E.
II e III.
Na determinação da pureza de uma amostra de calcita, CaCO3, por determinação gravimétrica, foi encontrado 90% de pureza. Assim, para uma amostra de 10,00 g de calcita, foi encontrado, em gramas de CaO, após calcinação a 800 °C,
Dado: massas molares (g/mol) Ca = 40; C = 12; O = 16
- A.
2,10
- B.
4,02
- C.
5,04
- D.
8,35
- E.
9,12
A tabela abaixo mostra os resultados de três métodos de análise de fósforo em águas naturais, testados em vários laboratórios.
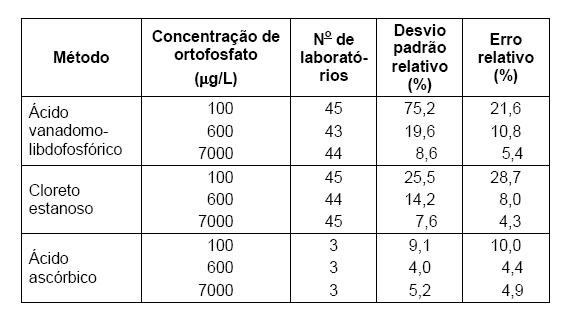
O método para análise de fósforo que possui maior precisão é
- A.
ácido vanadomolibdofosfórico, para concentração de 100 μg/L.
- B.
ácido vanadomolibdofosfórico, para concentração de 600 μg/L.
- C.
cloreto estanoso, para concentração de 100 μg/L.
- D.
cloreto estanoso, para concentração de 7000 μg/L.
- E.
ácido ascórbico, para concentração de 7000 μg/L.
O pH mais elevado, no ponto estequiométrico de uma titulação, será observado na reação de NaOH 0,1 mol/L com uma solução de mesma concentração de
- A.
HCl (pKa = −7)
- B.
HNO3 (pKa = −2)
- C.
HCOOH (pKa = 3,75)
- D.
H3CCOOH (pKa = 4,76)
- E.
H3CCH2COOH (pKa = 4,88)
O óxido nitroso, N2O, forma-se em processos microbiológicos e ocorre em concentrações de até 0,25 mg/L, no ar. Assim, a quantidade máxima de N2O, em gramas, encontrada na análise de 100 m3 de ar é, aproximadamente,
- A.
25
- B.
50
- C.
100
- D.
250
- E.
500


