Questões de Engenharia Química da Centro de Seleção e de Promoção de Eventos UnB (CESPE)
Lista completa de Questões de Engenharia Química da Centro de Seleção e de Promoção de Eventos UnB (CESPE) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
A respeito de calor e energia, assinale a opção correta.
- A. Conforme a primeira lei da termodinâmica, em um sistema isolado, a energia total varia em função da temperatura.
- B. A quantidade de calor necessária para variar a temperatura de um sistema depende do grau de variação da temperatura que se pretende atingir e da pressão inicial do sistema.
- C. A energia interna de um sistema pode ser composta de diferentes fontes, como energias química, eletrônica, nuclear e cinética.
- D. Um material isolante térmico, como o isopor, e um material plástico maleável requerem a mesma quantidade de calor para serem aquecidos ou resfriados à mesma temperatura.
- E. Um sistema fechado não permite a saída nem a entrada de matéria ou energia, ao passo que um sistema isolado permite a passagem de energia, mas não de matéria.
Acerca da segunda lei da termodinâmica, de entropia e de espontaneidade de reações, assinale a opção correta.
- A. De acordo com a segunda lei da termodinâmica, a mistura de dois ou mais gases, quando ocorre em um sistema isolado, é um processo espontâneo.
- B. É necessário haver trabalho diferente de zero para que ocorram reações espontâneas.
- C. Sendo o calor de vaporização do benzeno (C6H6) igual a 395 J/g, a variação de entropia é maior que 4,2 J/gK quando 2 g de benzeno fervem reversivelmente em seu ponto de ebulição, ou seja, a 80,1 ºC, e em pressão constante de 1 atm.
- D. A ocorrência de uma transformação não espontânea em um sistema isolado implica aumento de energia.
- E. Reações endotérmicas não podem ser espontâneas.
Acerca da Lei de Hess e de entalpias de formação, assinale a opção correta.
- A. Ao se considerar o múltiplo de uma reação, deve-se utilizar o mesmo múltiplo para calcular a variação de energia, haja vista ser a entalpia uma propriedade intensiva.
- B. A entalpia de formação dos elementos em seu estado padrão sempre é negativa.
- C. A termoquímica estuda as variações de energia das reações químicas em termos de calor e velocidade de reação.
- D. Novas transformações químicas podem derivar da combinação de reações químicas conhecidas, haja vista ser a entalpia da equação global resultante da soma das entalpias das reações individuais.
- E. Na determinação da equação global, o sinal da variação de energia da reação é mantido quando uma das reações é invertida, em razão de a entalpia ser uma função de estado.
Com relação à variação de entropia (ΔS) e à variação da energia livre de Gibbs (ΔG), assinale a opção correta.
- A. Sob pressão e temperatura constantes, um sistema está em equilíbrio caso ΔG seja igual a zero.
- B. Estando a entropia e a pressão constantes, um processo será espontâneo quando a variação de entalpia for positiva.
- C. Um processo isobárico espontâneo ocorre quando a variação de energia interna é negativa e ΔS é igual a zero.
- D. A limitação da condição de espontaneidade para ΔS < 0 se aplica apenas a sistemas isolados adiabáticos, sem realização de trabalho.
- E. Para uma reação na qual o ΔG aumente com avanço da conversão dos reagentes em produtos, o processo é denominado espontâneo.
Considerando que a constante universal dos gases seja 8,31451 kPaLK-1mol-1, o valor da pressão exercido por 5,6 g de nitrogênio gasoso em um frasco de volume igual a 200 mL, a 20 ºC, em quilopascal (kPa) é
- A. superior a 5.000 e inferior a 7.000.
- B. superior a 400 e inferior a 700.
- C. superior a 700 e inferior a 1.000.
- D. superior a 1.000 e inferior a 3.000.
- E. superior a 3.000 e inferior a 5.000.
A respeito das propriedades dos gases, assinale a opção correta.
- A. De acordo com o conceito de temperatura crítica, se um recipiente fechado que contenha líquido for continuamente aquecido, será observado apenas o líquido quando o recipiente atingir sua temperatura crítica.
- B. Um gás não pode ser condensado em um líquido devido ao aumento de pressão, a menos que a temperatura esteja acima da temperatura crítica.
- C. O fator de compressibilidade de um gás real é igual a 1 em quaisquer condições de temperatura e pressão.
- D. À baixa pressão, qualquer gás apresenta o parâmetro fator de compressibilidade positivo, o que está relacionado à dominância de interações repulsivas entre suas moléculas.
- E. A variação da temperatura afeta diretamente a velocidade de difusão de moléculas gasosas, por isso moléculas de amostras de gás em alta temperatura apresentam maior coeficiente de difusão que moléculas de amostras de gás em baixa temperatura.
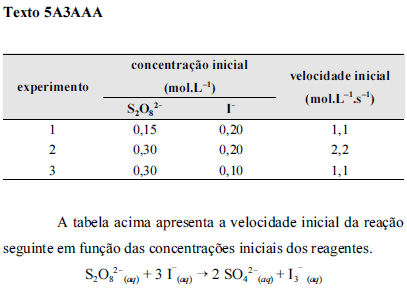
Considerando-se que k seja a constante de velocidade da reação apresentada no texto 5A3AAA, é correto afirmar que a lei de velocidade para essa reação é
- A.

- B.

- C.

- D.

- E.

A relação correta entre as taxas de variações das concentrações das espécies envolvidas na reação apresentada no texto 5A3AAA, desconsiderando a ocorrência de intermediários, é
- A.

- B.

- C.

- D.

- E.

A respeito da reação elementar 2A (g)  produto, assinale a opção correta.
produto, assinale a opção correta.
- A. A remoção do produto, durante a reação, favorecerá a cinética da reação porque isso propiciará um aumento da fração de colisões efetivas entre as moléculas do reagente A.
- B. A adição de um catalisador favorecerá a cinética da reação porque ele fornecerá energia à espécie reagente, aumentando assim o número total de colisões das moléculas do reagente A.
- C. A adição de um gás inerte favorecerá a cinética da reação porque ele cria um caminho reacional alternativo com menor energia de ativação.
- D. Um aumento de temperatura favorecerá a cinética da reação, principalmente porque ocorrerá um aumento da fração de colisões efetivas entre as moléculas do reagente A.
- E. Um aumento da pressão parcial do reagente A favorecerá a cinética da reação porque será aumentada a fração de colisões efetivas entre as moléculas do reagente A.
Ainda em relação à reação elementar 2A (g) produto, assinale a opção cujo gráfico representa o comportamento da concentração da espécie reagente A em função do tempo.
produto, assinale a opção cujo gráfico representa o comportamento da concentração da espécie reagente A em função do tempo.
- A.

- B.

- C.

- D.

- E.



