Questões de Química
Lista completa de Questões de Química para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Verifique as definições das assertivas e assinale a opção correta. I. Todo hidrocarboneto que permanece em estado gasoso nas condições atmosféricas normais, extraído diretamente a partir de reservatórios petrolíferos ou gaseíferos, cuja composição poderá conter gases úmidos, secos e residuais; II. Gás natural processado e acondicionado para o transporte em ampolas ou cilindros à temperatura ambiente e a uma pressão que o mantenha em estado gasoso. III. Gás natural submetido a processo de liquefação para acondicionamento e transporte.
-
A) I - Gás Natural Comprimido (GNC); II - Gás Natural Liquefeito (GNL); III - Gás Natural.
B) I - Gás Natural; II - Gás Natural Comprimido (GNC); III - Gás Natural Liquefeito (GNL).
C) I - Gás Natural Comprimido (GNC); II - Gás Natural; III - Gás Natural Liquefeito (GNL).
D) I - Gás Natural Liquefeito (GNL); II - Gás Natural; III - Gás Natural Comprimido (GNC).
Ocorrendo um incêndio numa instalação elétrica, podemos utilizar extintores com que tipo de carga?
-
A) Pó BC, CO2 e água.
B) Pó BC, pó ABC e CO2.
C) Pó BC, pó ABC e água.
D) CO2, água e espuma.
E) Água, pó ABC e CO2.
Segundo o Código de Águas Minerais (Decreto-Lei nº 7.841, de 08 de agosto de 1945), águas minerais são aquelas provenientes de fontes naturais ou de fontes artificialmente captadas que possuem composição química ou propriedades físicas ou físico-químicas distintas das águas comuns, com características que lhes conferem uma ação medicamentosa (http://www.cprm.gov.br). De acordo com a composição química, as águas minerais que contêm substâncias radioativas dissolvidas, o que lhes dá radioatividade permanente são denominadas:
-
A) Radioativas.
B) Alcalino-bicarbonatadas.
C) Radíferas.
D) Toriativas.
E) Sulfurosas.
Na Tabela Periódica atual, os elementos químicos são agrupados em quatro grupos principais, segundo as suas propriedades físicas e químicas. Na imagem a seguir, qual o nome do grupo destacado pela seta?
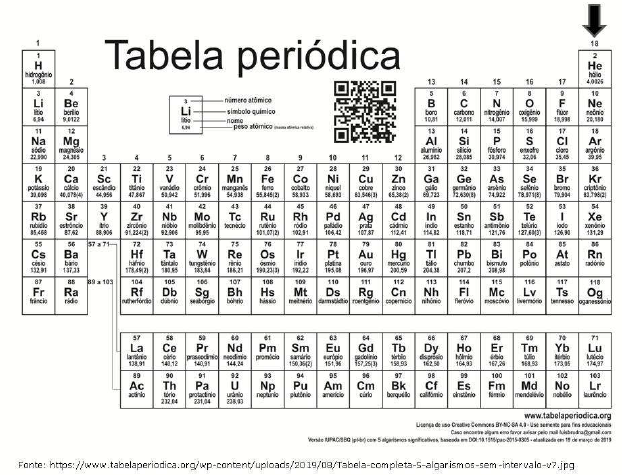

-
A) Metais.
B) Gases nobres.
C) Semimetais.
D) Ametais.
E) Metais alcalinos.
Calcule a concentração em mol/L ou molaridade de uma solução que foi preparada dissolvendo-se 20 gramas de sufato ferroso (FeSO4) em água suficiente para produzir 1 litro da solução. (Dado: massa molar do sulfato ferroso = 152 g/mol).
m = 20/ (152g.mol).(1.0) m = 0,13
m = 20/ (152g.mol).(1.0) m = 0,13
-
A) 0,152.
B) 0,13.
C) 15.
D) 131,57.
E) 20.
O lítio, o sódio, o potássio, o rubídio, o césio e o frâncio estão na família A1 da Tabela Periódica e são classificados como:
-
A) metais alcalinos terrosos.
B) não metais.
C) semimetais.
D) metais alcalinos.
E) metais de transição.
Qual tipo de isomeria a figura representa?
-
A) Função.
B) Posição.
C) Compensação.
D) Tautomeria.
E) Cadeia.
A respeito das definições, em Química para base e ácido (base é a substância capaz de aceitar prótons, e ácido é aquela que doa prótons), tradicionalmente os corantes catiônicos são referidos como básicos e os aniônicos como ácidos. Nesse caso, corante básico é aquele capaz de formar uma ligação eletrostática com grupos carregados negativamente no tecido, enquanto o corante ácido forma uma ligação eletrostática com grupos positivos do tecido. Sendo assim, corantes considerados básicos são:
-
A) hematoxilina, azul de metileno, azul de toluidina, azul de alcian e fucsina.
B) hematoxilina, xylidine ponceau, azul de toluidina, azul de alcian e fucsina.
C) hematoxilina, azul de metileno, floxina, azul de alcian e fucsina.
D) hematoxilina, azul de metileno, azul de toluidina, azul de anilina e fucsina.
E) hematoxilina, azul de metileno, azul de toluidina, azul de alcian e verde luz.
O cloreto de sódio contém cátions Na+ e ânions Cl- . Em solução, esses íons ficam livres. Essa solução é chamada:
-
A) Solução eletrolítica.
B) Solução não eletrolítica.
C) Solução acuosa.
D) Solução iônica.
E) Solução catiônica.
Considere que em uma amostra de água fluvial foi analisada a concentração de Fe+2 por meio da titulação redox. Para isso retirou-se uma alíquota de 50 mL da amostra da água, que foi titulada com uma solução-padrão de KMnO4 0,10 mol/L em meio ácido.
Se 20 mL da solução de permanganato são necessários para atingir o ponto final da titulação, a concentração de íon ferro (II), em mol/L, na água fluvial, é igual a
-
A) 0,04.
B) 0,10.
C) 0,20.
D) 0,40.


