Questões de Química do ano 2004
Lista completa de Questões de Química do ano 2004 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2004
A energia é fundamental para a realização de qualquer atividade humana. Na sociedade moderna, grande parte da energia utilizada é proveniente da queima de combustíveis. Por isso, existe um permanente interesse em compreender como ocorre o fluxo de energia entre sistemas durante um processo, em particular em reações de combustão. Acerca das reações de combustão e do processo de transferência de energia entre os sistemas e suas vizinhanças, julgue os itens a seguir.
O valor medido da temperatura ao final de uma combustão é maior que a temperatura adiabática de chama calculada porque vários fatores interferem na medida, entre eles a dissociação dos produtos. Esse fator libera a energia acumulada nas ligações químicas que se rompem, aumentando ainda mais a temperatura final.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2004
A energia é fundamental para a realização de qualquer atividade humana. Na sociedade moderna, grande parte da energia utilizada é proveniente da queima de combustíveis. Por isso, existe um permanente interesse em compreender como ocorre o fluxo de energia entre sistemas durante um processo, em particular em reações de combustão. Acerca das reações de combustão e do processo de transferência de energia entre os sistemas e suas vizinhanças, julgue os itens a seguir.
Os produtos de uma combustão que ocorre sem troca de calor com as vizinhanças e por um processo isobárico são obtidos em temperatura conhecida como temperatura adiabática de chama, que é diferente da temperatura inicial.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2004
A energia é fundamental para a realização de qualquer atividade humana. Na sociedade moderna, grande parte da energia utilizada é proveniente da queima de combustíveis. Por isso, existe um permanente interesse em compreender como ocorre o fluxo de energia entre sistemas durante um processo, em particular em reações de combustão. Acerca das reações de combustão e do processo de transferência de energia entre os sistemas e suas vizinhanças, julgue os itens a seguir.

- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2004
A energia é fundamental para a realização de qualquer atividade humana. Na sociedade moderna, grande parte da energia utilizada é proveniente da queima de combustíveis. Por isso, existe um permanente interesse em compreender como ocorre o fluxo de energia entre sistemas durante um processo, em particular em reações de combustão. Acerca das reações de combustão e do processo de transferência de energia entre os sistemas e suas vizinhanças, julgue os itens a seguir.
Considere que as entalpias-padrão de combustão do carbono sólido, do hidrogênio gasoso e do metano gasoso sejam iguais, respectivamente, a -394 kJ/mol, -286 kJ/mol e -890 kJ/mol, na temperatura de 25 oC. Nessa situação, é correto afirmar que a entalpia-padrão de formação do metano gasoso, a 25 oC, é menor que !70 kJ/mol.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2004
A energia é fundamental para a realização de qualquer atividade humana. Na sociedade moderna, grande parte da energia utilizada é proveniente da queima de combustíveis. Por isso, existe um permanente interesse em compreender como ocorre o fluxo de energia entre sistemas durante um processo, em particular em reações de combustão. Acerca das reações de combustão e do processo de transferência de energia entre os sistemas e suas vizinhanças, julgue os itens a seguir.
Assuma que o calor de combustão de um mol de metano, em uma reação que forma 1 mol de dióxido de carbono e 2 mols de água líquida, é igual a -890 kJ a 25 oC e 100 kPa de pressão. Nessa situação, a soma das entalpias dos produtos é menor que a soma das entalpias dos reagentes, nas mesmas condições da reação apresentada.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2004
A energia é fundamental para a realização de qualquer atividade humana. Na sociedade moderna, grande parte da energia utilizada é proveniente da queima de combustíveis. Por isso, existe um permanente interesse em compreender como ocorre o fluxo de energia entre sistemas durante um processo, em particular em reações de combustão. Acerca das reações de combustão e do processo de transferência de energia entre os sistemas e suas vizinhanças, julgue os itens a seguir.
Admitindo que, na temperatura de 25 oC e 100 kPa de pressão, as entalpias de formação do dióxido de carbono, do butano e da água líquida sejam iguais, respectivamente, a -393 kJ/mol, -126 kJ/mol e -286 kJ/mol, é correto concluir que o calor de combustão de 1 mol de butano a 25 oC e 100 kPa de pressão é maior que -560 kJ.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2004
A energia é fundamental para a realização de qualquer atividade humana. Na sociedade moderna, grande parte da energia utilizada é proveniente da queima de combustíveis. Por isso, existe um permanente interesse em compreender como ocorre o fluxo de energia entre sistemas durante um processo, em particular em reações de combustão. Acerca das reações de combustão e do processo de transferência de energia entre os sistemas e suas vizinhanças, julgue os itens a seguir.
O calor de reação da combustão isobárica do carbono, caso esta ocorra em um sistema fechado, independe da temperatura do meio reacional.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2004
A energia é fundamental para a realização de qualquer atividade humana. Na sociedade moderna, grande parte da energia utilizada é proveniente da queima de combustíveis. Por isso, existe um permanente interesse em compreender como ocorre o fluxo de energia entre sistemas durante um processo, em particular em reações de combustão. Acerca das reações de combustão e do processo de transferência de energia entre os sistemas e suas vizinhanças, julgue os itens a seguir.
Na combustão da octana, representada na equação química a seguir, a entropia dos produtos é menor que a entropia dos reagentes.
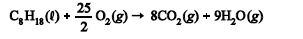
- C. Certo
- E. Errado
A energia é fundamental para a realização de qualquer atividade humana. Na sociedade moderna, grande parte da energia utilizada é proveniente da queima de combustíveis. Por isso, existe um permanente interesse em compreender como ocorre o fluxo de energia entre sistemas durante um processo, em particular em reações de combustão. Acerca das reações de combustão e do processo de transferência de energia entre os sistemas e suas vizinhanças, julgue os itens a seguir.
A variação do termo entrópico da reação de combustão do metanol (CH3OH) é sempre igual ao calor liberado por essa reação, porque a entropia é uma função de estado.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2004
A energia é fundamental para a realização de qualquer atividade humana. Na sociedade moderna, grande parte da energia utilizada é proveniente da queima de combustíveis. Por isso, existe um permanente interesse em compreender como ocorre o fluxo de energia entre sistemas durante um processo, em particular em reações de combustão. Acerca das reações de combustão e do processo de transferência de energia entre os sistemas e suas vizinhanças, julgue os itens a seguir.
Suponha que 1 mol de metano (CH4) gasoso seja completamente queimado a volume constante, consumindo 2 mols de oxigênio, em um reservatório rígido e selado. Nesse caso, é correto concluir que o calor liberado pela reação é exatamente igual à diferença entre a energia interna dos produtos e a dos reagentes.
- C. Certo
- E. Errado


