Questões de Química do ano 2006
Lista completa de Questões de Química do ano 2006 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
A coloração utilizada em esfregaços, para diagnóstico de microorganismos (bacilos de Kock), é
- A.
Papanicolaou.
- B.
Hematoxilina – eosina.
- C.
Giemsa.
- D.
Ácido periódico Schiff (PAS).
- E.
Mucicarmin de Mayer.
Em relação aos microscópios, é incorreto afirmar.
- A.
O microscópio óptico comum é o mais utilizado para exames de cortes e preparações histológicas.
- B.
O microscópio de luz polarizada detecta material polarizante, como cristais, etc.
- C.
O microscópio de campo escuro é útil na identificação de microorganismos (espiroquetas, etc.).
- D.
O microscópio de contraste de fase permite a análise de células vivas, não coradas.
- E.
O microscópio eletrônico fornece aumentos de até 1000X e permite a análise morfológica em planos de diversas profundidades.
Em relação à coloração de azul de toluidina, é correto afirmar.
- A.
Trata-se de uma coloração policromática.
- B.
Cora, apenas, o cálcio.
- C.
Cora glicosaminoglicanos e outras substâncias metacromáticas.
- D.
Cora BAAR (bacilos álcool-ácido resistentes).
- E.
Cora o corpo celular dos neurônios.
Em relação à utilização do instrumental de laboratório, o Erlenmeyer, assinale, dentre as alternativas abaixo, a incorreta.
- A.
Filtração.
- B.
Destilação.
- C.
Titulação.
- D.
Dissolução.
- E.
Fonte de energia.
Química - Geral - Instituto de Planejamento e Apoio ao Desenvolvimento Tecnológico e Científico (IPAD) - 2006
Assinale a alternativa que indica a vidraria que é usada em medidas aproximadas do volume dos líquidos.
- A.
Cadinho de porcelana.
- B.
Tubo de ensaio.
- C.
Copo de Becker
- D.
Proveta
- E.
Balão de fundo chato.
O gás natural pode se originar de um reservatório de óleo ou de gás. O reservatório de gás é caracterizado como sendo o reservatório em que a jazida de petróleo, que contém a mistura de hidrocarbonetos encontra-se no estado gasoso em condições de reservatório. Esse tipo de reservatório se subdivide em:
I. reservatório de gás úmido;
II. reservatório de gás seco;
III reservatório de gás retrógrado.
A figura a seguir mostra um exemplo do diagrama de fase de um reservatório de gás úmido.

Em relação à figura acima, pode-se afirmar que:
- A.
o ponto crítico para uma mistura (gás-líquido) é o ponto na qual todos as propriedades do líquido e gás tornam-se idênticas.
- B.
a temperatura crítica da mistura é maior do que as temperaturas dos componentes da mistura.
- C.
no ponto 2 co-existem duas fases (gás + condensado).
- D.
no ponto 3 (condição de separador), a fração de líquido está entre 25% e 50%.
- E.
no ponto 3 (condição de separador), não existe nenhuma fração de condensado.
Uma canalização escoa gás natural do ponto A para o ponto B e para o ponto C, conforme mostrado na figura abaixo. No ponto B existe uma derivação que alimenta de gás o ponto D. Sabendo-se que a pressão inicial no ponto A é de 16 kgf/cm2, e as perdas de carga de cada trecho são AB = 2 kgf/cm2; BC = 3 kgf/cm2 e BD = 4 kgf/cm2, quais são as pressões finais nos pontos C e D?
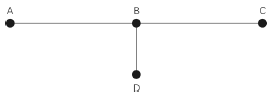
- A.
No ponto C, igual a 13 kgf/cm2, e, no ponto D, igual a 12 kgf/cm2
- B.
No ponto C, igual a 14 kgf/cm2, e, no ponto D, igual a 12 kgf/cm2
- C.
No ponto C, igual a 12 kgf/cm2, e, no ponto D, igual a 11 kgf/cm2
- D.
No ponto C, igual a 11 kgf/cm2, e, no ponto D, igual a 10 kgf/cm2
- E.
No ponto C, igual a 10 kgf/cm2, e, no ponto D, igual a 11 kgf/cm2
A combustão representa as reações químicas que se produzem durante a oxidação completa ou parcial do carbono e do hidrogênio contidos no gás natural. Essa reação necessita de uma fonte externa de energia para iniciar-se (uma centelha ou faísca). Sobre a combustão do gás natural, analise as afirmativas a seguir:
I. Sendo feita com ar insuficiente, a reação de combustão é oxidante (índice de excesso de ar < 1).
II. Se a combustão for feita com excesso de ar, a reação é redutora (índice de excesso de ar > 1).
III. A combustão estequiométrica se realiza com a quantidade exata de ar (ar teórico ou estequiométrico), necessária para uma combustão completa (índice de excesso de ar = 1). Ela nunca ocorre na prática devido à imperfeição dos sistemas.
Assinale:
- A.
se nenhuma afirmativa estiver correta.
- B.
se apenas a afirmativa I estiver correta.
- C.
se apenas a afirmativa III estiver correta.
- D.
se apenas as afirmativas I e III estiverem corretas.
- E.
se todas as afirmativas estiverem corretas.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação Getúlio Vargas (FGV) - 2006
Considerando que o gás natural e o GLP são dois gases combustíveis, com propriedades físicas, químicas e de combustão distintas, analise as seguintes comparações:
I. O GLP é mais pesado que o ar, e o gás natural é mais leve que o ar.
II. O poder calorífico de 1m3 de GLP, nas condições normais de temperatura e pressão (CNTP), é menor que o poder calorífico do de 1m3 de gás natural, nas mesmas condições normais de temperatura e pressão.
III. Os componentes predominantes do GLP são o propano e o butano, enquanto que, no gás natural, o componente predominante é o etano. Assinale:
- A.
se nenhuma comparação estiver correta.
- B.
se apenas a comparação I estiver correta.
- C.
se apenas a comparação II estiver correta.
- D.
se apenas as comparações I e II estiverem corretas.
- E.
se todas as comparações estiverem corretas.
Considere uma amostra de metanol (CH3OH). Quanto maior for a massa dessa amostra, maior será o valor
- A.
porcentagem, em massa, de cada elemento nela presente.
- B.
sua temperatura de ebulição, sob mesma pressão.
- C.
energia térmica liberada na sua combustão total.
- D.
sua pressão de vapor, na mesma temperatura.
- E.
sua densidade, na mesma temperatura.


