Questões de Química do ano 2011
Lista completa de Questões de Química do ano 2011 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Três soluções, I, II e III, foram preparadas adicionando-se uma mesma quantidade de matéria dos seguintes solutos: solução I ureia ((NH2)2CO); solução II ácido sulfúrico (H2SO4); solução III ácido acético (CH3COOH). As três soluções foram preparadas com uma mesma massa de solvente, a saber, água. Considerando o comportamento ideal e definindo as temperaturas de início de congelamento das três soluções como: TI, TII e TIII, respectivamente, a relação entre estas temperaturas será
- A. TI = TIII< TII
- B. TI < TIII< TII
- C. TII = TIII< TI
- D. TI = TII = TIII
- E. TII < TIII< TI
Um sabão muito comum é o estearato de sódio, C17H35COO- Na+. Este composto possui uma grande cadeia carbônica, de natureza apolar, e uma extremidade iônica, de natureza polar. Essa característica confere ao sabão a capacidade de interagir com um grande número de substâncias de naturezas distintas. Em soluções aquosas, em baixas concentrações, os íons estearato e sódio ficam dispersos. Elevando essa concentração, os íons estearato se aglomeraram formando micelas. Estas micelas são carregadas e possuem o tamanho de uma partícula coloidal. Sobre essa solução onde se formaram as micelas, pode-se afirmar que:
I a condutividade elétrica da solução permanece inalterada após a formação das micelas, uma vez que não se alterou o número de cargas na solução; II a formação das micelas reduz a pressão osmótica da solução, que é dependente da quantidade de partículas presentes na solução; III as micelas podem ser separadas do resto da solução por filtração simples. Está correto o que se afirma em- A. I, apenas.
- B. II, apenas.
- C. I e II, apenas.
- D. I e III, apenas.
- E. I, II e III.
Utilizando benzeno como solvente, foi preparada uma solução com um soluto não volátil. A determinação da temperatura de congelamento e de ebulição da solução forneceu os respectivos valores, - 4,5 oC e 85,2 oC. Considerando o comportamento ideal e conhecendo os valores de ponto de ebulição e congelamento do benzeno puro, 80,2 oC e 5,5 oC, respectivamente, tem-se que a
- A. constante crioscópica do benzeno equivale a aproximadamente 10 K.kg .mol-1, e a constante ebulioscópica do benzeno equivale a aproximadamente 2,5 K.kg .mol-1.
- B. constante ebulioscópica do benzeno é aproximadamente quatro vezes menor que sua constante crioscópica.
- C. constante ebulioscópica do benzeno é aproximadamente duas vezes menor que sua constante crioscópica.
- D. molalidade da solução preparada é de 0,5 mol.kg-1.
- E. molalidade da solução preparada é de 10,0 mol.kg-1.
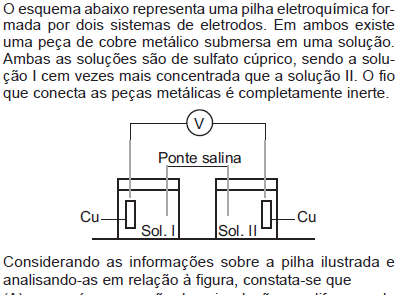
- A. ocorrerá uma reação de oxirredução e a diferença de potencial pode ser calculada a partir da equação de Nernst.
- B. ocorrerá uma reação de oxirredução, e a peça de cobre que está em contato com a solução I sofrerá oxidação.
- C. ocorrerá uma reação de oxirredução; porém, não é possível, a partir das informações fornecidas, estimar qual das peças sofrerá oxidação.
- D. não ocorrerá nenhuma reação, pois as peças metálicas em contato são da mesma natureza.
- E. não ocorrerá nenhuma reação, pois as peças de cobre metálico estão em contato com íons do próprio metal.

- A. 1074
- B. 1050
- C. 1035
- D. 1024
- E. 1012
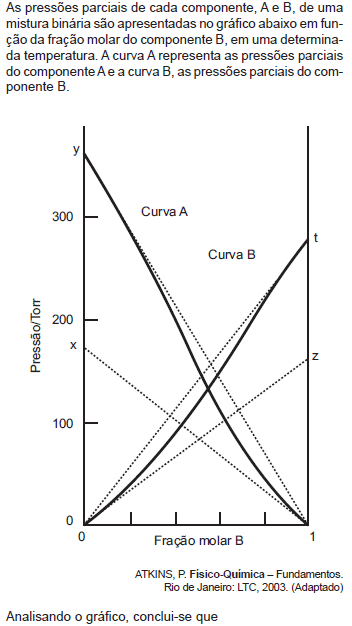
- A. o ponto x representa a pressão parcial de A quando puro, e o ponto z, a pressão parcial de B quando puro.
- B. o ponto x representa a constante da lei de Henry para A, e o ponto t, a pressão parcial de B quando puro.
- C. o ponto y representa a constante de Henry para A, e o ponto t representa a constante de Henry para B.
- D. a reta que vai do ponto x até o valor 1 (de fração molar de B) é a representação da lei de Raoult para A, enquanto a reta que vai do valor 0 (de fração molar de B) até o ponto t é a representação da lei de Raoult para B.
- E. a reta que vai do ponto y até o valor 1 (de fração molar B) é a representação da lei de Henry para A, enquanto a reta que vai do valor 0 (de fração molar de B) até o ponto z é a representação da lei de Henry para B.
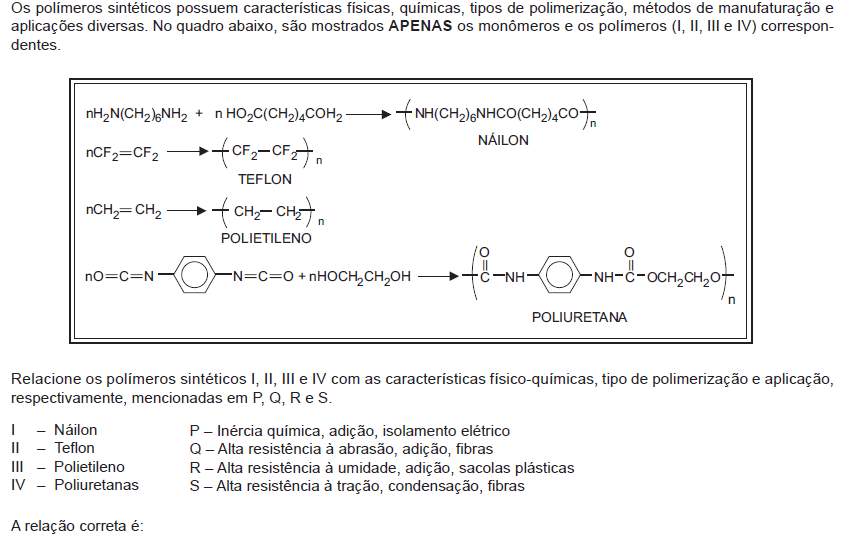
- A. I - Q, II - R, III - P, IV - S.
- B. I - Q, II - P, III - R, IV - S.
- C. I - S, II - R, III - P, IV - Q.
- D. I - R, II - Q, III - S, IV - P.
- E. I - S, II - P, III - R, IV - Q.
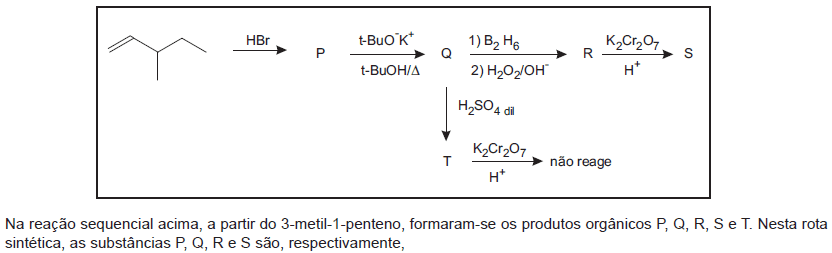
- A. 1-bromo-3-metil-pentano, 3-metil-pent-1-eno, 3-metil-butan-1-ol, 3-metil-butanal
- B. 1-bromo-3-metil-pentano, 3-metil-pent-1-eno, 3-metil-butan-3-ol, 3-metil-3-butanona
- C. 2-bromo-3-metil-pentano, 3-metil-pent-1-eno, 3-metil-butan-2-ol, 3-metil-2-butanona
- D. 2-bromo-3-metil-pentano, 3-metil-pent-2-eno, 3-metil-pentan-1-ol, 3-metil-butanal
- E. 3-bromo-3-metil-pentano, 3-metil-pent-2-eno, 3-metil-butan-2-ol, 3-metil-2-butanona
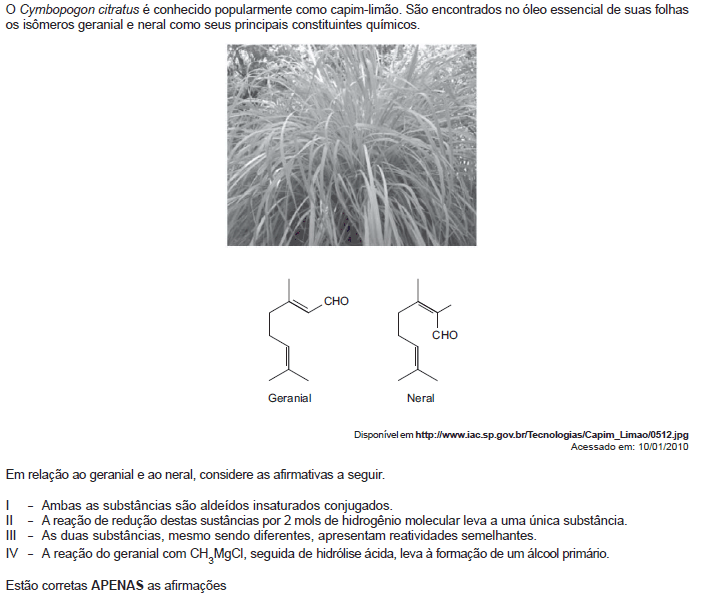
- A. I e IV.
- B. II e III.
- C. III e IV.
- D. I, II, e III.
- E. I, II e IV.
A reação de ozônio com alcenos pode ser empregada para a identificação estrutural desta classe de hidrocarboneto.
PORQUE A reação de ozonólise de alcenos, seguida de tratamento com Zn e H2O ou ácido acético, leva à quebra da ligação dupla e à formação de compostos carbonilados. Analisando as afirmações acima, conclui-se que- A. as duas afirmações são verdadeiras e a segunda justifica a primeira.
- B. as duas afirmações são verdadeiras e a segunda não justifica a primeira.
- C. a primeira afirmação é verdadeira e a segunda é falsa.
- D. a primeira afirmação é falsa e a segunda é verdadeira.
- E. as duas afirmações são falsas.


