Questões sobre Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica
Lista completa de Questões sobre Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
Alcoóis, sobretudo o metanol e o etanol, têm sido utilizados para substituir combustíveis líquidos. Eles podem ser diretamente queimados como combustíveis para gerar energia. No entanto, eles são usados também indiretamente. Por exemplo, o metanol é empregado para a formação de gasolina em uma reação catalisada por zeólitas, que são aluminossilicatos. As zeólitas são sólidos resultantes da substituição de alguns íons de Si +4 dos silicatos (óxidos de silício) por íons Al +3 . Sua função como catalisador está relacionada à sua capacidade em liberar íons H + . Considerando essas informações, julgue os itens seguintes.
Considerando-se que os íons citados no texto são obtidos quando os respectivos átomos cedem todos seus elétrons de orbitais da camada de valência, que são do tipo s e p, é correto afirmar que o alumínio é do grupo 3 (ou IIIB) e o silício, do grupo 4 (ou IVB).
- C. Certo
- E. Errado
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
Alcoóis, sobretudo o metanol e o etanol, têm sido utilizados para substituir combustíveis líquidos. Eles podem ser diretamente queimados como combustíveis para gerar energia. No entanto, eles são usados também indiretamente. Por exemplo, o metanol é empregado para a formação de gasolina em uma reação catalisada por zeólitas, que são aluminossilicatos. As zeólitas são sólidos resultantes da substituição de alguns íons de Si +4 dos silicatos (óxidos de silício) por íons Al +3 . Sua função como catalisador está relacionada à sua capacidade em liberar íons H + . Considerando essas informações, julgue os itens seguintes.
Sabendo-se que o silício e o alumínio estão no 3. o período da tabela periódica, é correto afirmar que todos os orbitais que compõem a camada de valência desses elementos têm o número quântico principal igual a 3.
- C. Certo
- E. Errado
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Associação Educacional Dom Bosco (AEDB) - 2007
Marie Curie e Pierre Curie, utilizando o minério URÂNIO, isolaram dois elementos químicos radioativos. São eles:
- A.
Flúor e Magnésio.
- B.
Raio X e Rádio.
- C.
Iodo e Cloro.
- D.
Raio Gama e Raios anódicos.
- E.
Polônio e Rádio.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
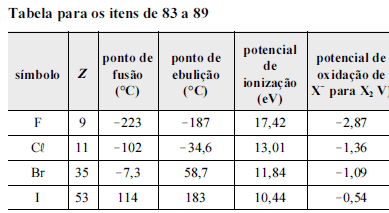
Considerando a tabela acima, em que X representa o elemento em questão, julgue os itens subseqüentes.
O bromo, que é um agente redutor mais forte que o iodo, possui menor tendência que este em perder elétrons.
- C. Certo
- E. Errado
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007


- C. Certo
- E. Errado
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
No método de espectrometria, o analito é introduzido no sistema, na forma aquosa, em uma câmara de expansão que o torna nebulizado. A seguir, por ação da fonte de plasma, ocorre dessolvatação, dissociação, atomização e ionização. Os íons são direcionados para o sistema analisador. Uma separação é feita em função da aceleração que é imposta a todos os íons, que respondem com diferentes velocidades, em função da relação massa/carga. Dessa forma, os parâmetros carga e massa dos íons determinam a ordem de chegada ao detector em tempos diferentes. No detector, os íons são contados por unidade de tempo (íons/segundo), havendo uma relação de proporcionalidade entre a contagem e a concentração.
Com relação ao método descrito acima, julgue os itens seguintes.
O sistema de detecção discrimina as massas dos isóbaros.
- C. Certo
- E. Errado
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
No método de espectrometria, o analito é introduzido no sistema, na forma aquosa, em uma câmara de expansão que o torna nebulizado. A seguir, por ação da fonte de plasma, ocorre dessolvatação, dissociação, atomização e ionização. Os íons são direcionados para o sistema analisador. Uma separação é feita em função da aceleração que é imposta a todos os íons, que respondem com diferentes velocidades, em função da relação massa/carga. Dessa forma, os parâmetros carga e massa dos íons determinam a ordem de chegada ao detector em tempos diferentes. No detector, os íons são contados por unidade de tempo (íons/segundo), havendo uma relação de proporcionalidade entre a contagem e a concentração.
Com relação ao método descrito acima, julgue os itens seguintes.
Quase todos os elementos da Tabela Periódica podem ser determinados por esse método.
- C. Certo
- E. Errado
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Instituto de Planejamento e Apoio ao Desenvolvimento Tecnológico e Científico (IPAD) - 2006
O Kps do hidróxido me magnésio é igual a 8,9 x 10-12, a 25oC. Qual a solubilidade do hidróxido de magnésio, nesta temperatura, em uma solução tendo pH igual a 12,00?
- A.
2,6 x 10-4 M.
- B.
1,3 x 10-4 M.
- C.
2,6 x 10-8 M.
- D.
8,9 x 10-12 M.
- E.
8,9 x 10-8 M.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação Carlos Chagas (FCC) - 2006
O teor de ácido etanóico, H3CCOOH, em vinagre pode ser determinado pela reação com uma base, como o hidróxido de sódio, NaOH. Nessa reação, a proporção entre o número de moléculas do ácido e da base que reagem é
- A. 1:1
- B. 1:2
- C. 2:1
- D. 2:3
- E. 3:1
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação Carlos Chagas (FCC) - 2006
Um gás ideal teve sua temperatura aumentada em cinco vezes a pressão constante. Assim, espera-se um volume final correspondente a
- A. um décimo do valor inicial.
- B. um quinto do valor inicial.
- C. duas vezes o valor inicial.
- D. dez vezes o valor inicial.
- E. cinco vezes o valor inicial.


