Questões sobre Geral
Lista completa de Questões sobre Geral para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Para nos manter vivos, o pH do sangue deve estar neutro entre 7,35 e 7,45. Uma pequena alteração pode matar. Numa crise de ansiedade ou histeria, quando se respira de modo ofegante, perde-se muito CO2. Isso faz com que o pH do sangue suba a 7,7 em poucos minutos, situação conhecida como alcalemia sanguínea. Às vezes, a ingestão de um simples calmante resolve o problema, a respiração volta ao normal e o sangue reestabelece o pH neutro. No sangue, o equilíbrio químico é dado pela equação: CO2 + H2O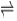 H+ + HCO3 Consumindo-se muito CO2, o equilíbrio se desloca para a esquerda consumindo os íons H+ e o sangue apresenta caráter básico. Se isso não funciona, é preciso uma intervenção médica injetando uma solução ácida de cloreto de amônio no sangue do paciente. O fato de um sal produzir a acidez necessária para neutralizar o sangue, pode ser explicado na seguinte alternativa:
H+ + HCO3 Consumindo-se muito CO2, o equilíbrio se desloca para a esquerda consumindo os íons H+ e o sangue apresenta caráter básico. Se isso não funciona, é preciso uma intervenção médica injetando uma solução ácida de cloreto de amônio no sangue do paciente. O fato de um sal produzir a acidez necessária para neutralizar o sangue, pode ser explicado na seguinte alternativa:
- A.
Ao dissolver o NH4Cl em água, o íon NH4 + derivado de uma base forte, captura os íons OH.
- B.
O NH4Cl dissolvido em água derivado de uma base fraca, faz sobrar H+ tornando-se ácida.
- C.
O cloreto de amônio não pode ser ministrado no organismo por ser derivado de um ácido forte.
- D.
Na água pura, existe H2O e íons H+ (responsável pela acidez) e OH (responsável pela basicidade) em concentrações diferentes.
- E.
É preciso uma solução ácida para neutralizar a alcalemia, reestabelecer o equilíbrio e manter o pH a níveis aceitáveis.
- A.
300 e 6
- B.
300 e 3
- C.
150 e 6
- D.
150 e 3
- E.
60 e 3
O refluxo ou azia é um mal que atinge grande parcela da população, podendo afetar até os bebês, e provoca uma sensação de queimação no estômago, podendo ter sido causada por motivos emocionais ou má alimentação. Pode ser explicada pelo excesso de acidez do suco gástrico (ácido clorídrico) que, de tão alta, evidencia e faz perceber a irritação causada nas paredes do trato digestivo. Para combatê-la, pode-se usar medicamentos que contêm antiácidos como o hidróxido de alumínio ou o hidróxido de magnésio necessários para neutralizar essa acidez. Ao ingerir esses antiácidos, provoca-se uma reação de neutralização que pode ser descrita em:
- A.
2HCl(aq) + Mg(OH)2(aq) ¨ MgCl2(aq) + H2O(l)
- B.
HCl(aq) + Al(OH)3(aq) ¨AlCl3(aq) + H2O(l)
- C.
HCl(aq) + Mg(OH)2(aq) ¨MgCl2(aq) + H2O(l)
- D.
3HCl(aq) + Mg(OH)2(aq) ¨ MgCl2(aq) + H3O+ (l)
- E.
3HCl(aq) + Al(OH)3(aq) ¨ AlCl3(aq) + 3 H2O(l)

- A. 28
- B. 30
- C. 31
- D. 32
- E. 33

- A.
I
- B.
II
- C.
III
- D.
I e II
- E.
II e III
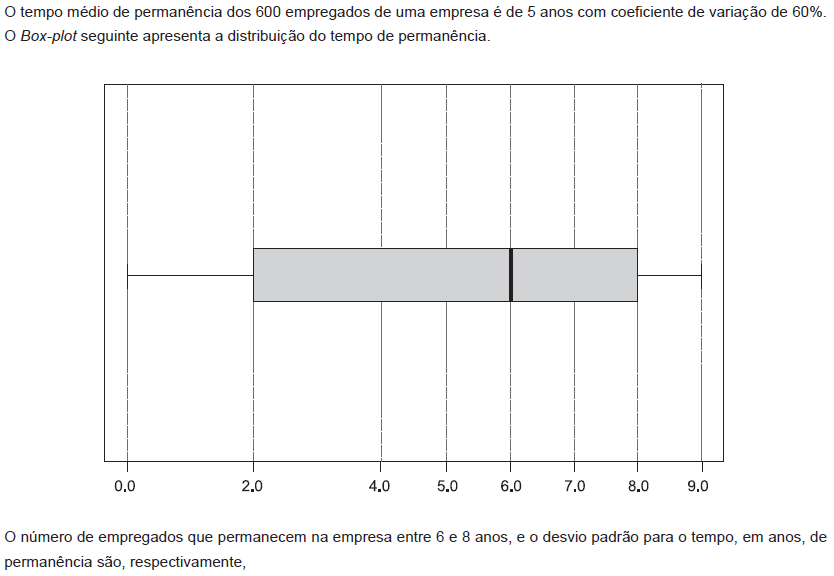
- A.
2 In (b − a)
- B.
In (b2 − a2)
- C.

- D.

- E.


- A. X II, V Y I, IV Z II, III
- B. X I, III Y I, III Z I, IV
- C. X I, V Y I, III Z II, III
- D. X I, III, V Y I, IV, V Z II, V
- E. X II, V Y I, IV, V Z II, III, V

- A.
1,00 V
- B.
1,02 V
- C.
1,05 V
- D.
1,07 V
- E.
1,12 V














