Questões sobre Leis Químicas
Lista completa de Questões sobre Leis Químicas para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
A Lei dos Gases Ideais é uma equação de estado que descreve a resposta de um gás ideal a mudanças de pressão, volume, temperatura e quantidade de moléculas. Entretanto, diversos processos industriais empregam determinadas condições de pressão e temperatura, as quais a lei dos gases ideais não são exatamente obedecidas. Nesse caso, o comportamento se assemelha ao dos gases reais. Em relação aos gases ideais e reais, analise as assertivas a seguir.
I. A lei dos gases ideais representada pela expressão PV= nRT pode ser usada para gases reais em baixas pressões.
II. O fator de compressão, Z, de um gás é a razão do volume molar do gás e o volume molar de um gás ideal nas mesmas condições. Portanto um gás ideal deveria apresentar Z=0, pois não há qualquer interação entre suas moléculas.
III. A equação do virial é uma equação geral usada para descrever gases reais e leva em consideração as forças de atração e repulsão intermoleculares.
IV. A equação de van der Waals é uma equação de estado aproximada de um gás real, que independente da temperatura, inclui parâmetros relacionados apenas com as forças de atração.
É(São) correta(s) apenas a(s) assertiva(s)
- A.
I.
- B.
III.
- C.
I e III.
- D.
II e IV.
- E.
I, III e IV.


- C. Certo
- E. Errado
A leitura de parâmetros no espectrofotômetro está baseada na lei de:
- A.
Preti.
- B.
Tompson.
- C.
Beer-Lambert.
- D.
Lavoisier.
- E.
Pasteur.
Um químico que atua na área de vigilância sanitária recebeu em seu laboratório um lote de amostras de ostras comercializadas em determinada praia do litoral brasileiro. Objetivando determinar os níveis de metais pesados (Hg, Mn, Zn, Cu e Fe) nesses organismos marinhos, o químico realizou a análise do material por meio da técnica de espectrofotometria de absorção atômica (EAA) com calibração externa embasada em padrões monoelementares.
Com base nessa situação hipotética e nas técnicas espectroscópicas, julgue os itens de 74 a 79.
Utilizando-se a lei de Beer-Lambert, a concentração (c) dos elementos no experimento descrito pode ser calculada pela expressão c = A×b×x, em que A é a absorbância medida, b é a absortividade molar do elemento e x, o trajeto óptico do feixe de radiação.
- C. Certo
- E. Errado
A combinação das Leis de Boyle, de Charles e de Avogadro gerou a Lei dos Gases Ideais, representada pela expressão PV = nRT. Essa é uma equação de estado que descreve a resposta de um gás ideal a mudanças de pressão, volume, temperatura e quantidade de moléculas. Entretanto, vários processos industriais e pesquisas em laboratório usam gases sob alta pressão ou em condições muito baixas de temperatura, condições às quais as leis dos gases ideais não são exatamente obedecidas. Nesses casos, o comportamento se assemelha ao dos gases reais. Em relação à teoria dos gases reais e ideais, afirma-se que
- A.
em uma quantidade fixa de gás em temperatura constante, o volume é diretamente proporcional à pressão, segundo a Lei de Boyle.
- B.
o volume de uma quantidade fixa de gás sob pressão constante varia inversamente com a temperatura, segundo a Lei de Charles.
- C.
o volume ocupado por uma amostra de gás sob pressão e temperatura constantes é inversamente proporcional ao número de mols de moléculas presentes, segundo o Princípio de Avogadro.
- D.
a equação do virial é uma equação geral usada para descrever gases reais e leva em consideração as forças de atração e de repulsão intermoleculares.
- E.
a equação de van der Waals é uma equação de estado aproximada de um gás real que, independente da temperatura, inclui parâmetros relacionados somente com as forças de atração.
Analise as afirmativas abaixo sobre as determinações analíticas quantitativas com base na Espectroscopia por Adsorção Molecular.
I - O método utilizado para a determinação quantitativa da concentração de uma substância através da absorção da radiação é baseada na Lei de Beer-Lambert.
II - A Lei de Beer é limitada a soluções diluídas porque considera que há interações dos centros absorventes com outras espécies presentes nestas soluções.
III - A Lei de Beer se aplica a soluções concentradas porque a interação entre as moléculas não afeta a distribuição de cargas na espécie absorvente, o que alteraria o coefi ciente de absortividade molar.
IV - Desvios químicos da Lei de Beer ocorrem quando um analito se dissocia, se associa ou reage com um solvente gerando um produto cujo espectro de absorção é diferente do analito.
Está correto APENAS o que se afirma em
- A.
I
- B.
I e II
- C.
I e IV
- D.
II e III
- E.
III e IV
No que se refere à evolução dos conceitos associados à ideia do átomo, assinale a opção correta.
- A.
Os principais aspectos do Efeito Fotoelétrico foram explicados adequadamente pela teoria ondulatória clássica da radiação.
- B.
A adequação do modelo de Thomson foi demonstrada por Ernest Rutherford, a partir de dados experimentais.
- C.
O modelo proposto por Thomson era concordante, do ponto de vista quantitativo, com os espectros observados experimentalmente, à época.
- D.
O fundamento básico da espectroscopia é revelar o efeito da interação da radiação com a matéria, qualquer que seja o seu estado físico.

Com relação ao assunto abordado nos textos, assinale a opção correta.
- A.
Dalton, ao demonstrar que gases diferentes não podiam ter partículas de mesmo tamanho, ratificou seu apoio à hipótese de Avogadro.
- B.
Dalton defendeu que, se existisse mais de um composto formado por dois elementos diferentes, os números dos átomos de cada elemento nos compostos guardariam entre si uma razão de números inteiros.
- C.
A principal declaração de Aristóteles de apoio à teoria atômica de Leucipo e Demócrito era sua capacidade de explicar as transformações químicas.
- D.
Lavoisier, dispondo de dados concretos, ofereceu subsídios para que, poucos anos depois, fosse apresentado o modelo de Dalton.
Os resultados empíricos fornecidos pelas leis dos gases sugeriram um modelo em que o gás ideal é formado por moléculas amplamente espaçadas, que não interagem entre si e que estão em movimento incessante e com velocidades médias que aumentam com a temperatura. Com relação a esses resultados, assinale a alternativa correta.
- A.
Considere-se uma mistura com mesmo número de mols de H2 e He. Nesse caso, o número de colisões das moléculas de cada gás, contra as paredes de um recipiente, será o mesmo.
- B.
A atmosfera terrestre é constituída, principalmente, de O2 e N2. A pressão parcial do O2 é diretamente proporcional ao número de mols da mistura.
- C.
Se um balão de aniversário foi enchido com gás hélio, a 20 ºC com 1,2 × 103 mol de He até completar o volume de 2,5 × 104 L, então o volume molar do gás é de cerca de 2,1 L × mol-1
- D.
Em um enxame de abelhas que perseguem alguém, como nos desenhos animados, a velocidade das abelhas, como a velocidade das moléculas, pode ser representada pela função de distribuição de Maxwell-Boltzmann, em um gráfico de número versus velocidade das abelhas.
- E.
A Lei dos Gases não leva em consideração a densidade deles.
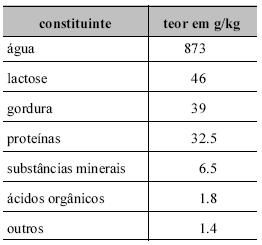
Considerando a tabela acima, que apresenta a composição aproximada do leite de vaca, cuja densidade aproximada é 1 g/mL, julgue os itens subseqüentes.
Em 10 L de leite, existem 8,73 kg de água.
- C. Certo
- E. Errado


