Questões sobre Práticas Laboratoriais em química
Lista completa de Questões sobre Práticas Laboratoriais em química para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
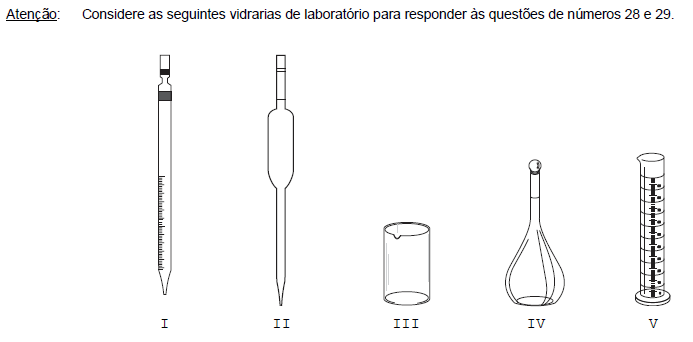 Para medida de um único valor de volume de líquido, estão calibradas cada uma das vidrarias constantes APENAS em
Para medida de um único valor de volume de líquido, estão calibradas cada uma das vidrarias constantes APENAS em
- A. I e III.
- B. II e IV.
- C. II e V.
- D. I, III e V.
- E. II, III e IV.
Química - Práticas Laboratoriais em química - FUNRIO Fundação de Apoio a Pesquisa, Ensino e Assistência (FUNRIO) - 2014
A qualidade dos combustíveis é verificada por meio de testes específicos que revelam se os produtos estão de acordo com as especificações estabelecidas pela Agência Nacional do Petróleo -ANP e, também se houve adição ilegal de solventes. O teste de teor de álcool presente na gasolina, conforme disposto na Resolução ANP nº 9, de 7 de março de 2007 é feito com solução aquosa de cloreto de sódio ( NaCl) na concentração de 10% p/v. O cálculo do teor de álcool é determinado pela expressão: T= (A X 2) +1, Onde: T = Teor de álcool na gasolina e A = aumento em volume da fase aquosa. Considerando um teor permitido de álcool na gasolina de 25%, pode-se dizer que uma amostra analisada pelo Teste da Proveta ao obter um aumento em volume de 30 mL da fase aquosa:
- A. Não está adulterada, pois o teor de gasolina é de 61%.
- B. Está adulterada, pois o teor de álcool na gasolina é de 30%.
- C. Não está adulterada, pois o teor de álcool na gasolina é de 15%.
- D. Está adulterada, pois o teor de álcool na gasolina é de 61%.
- E. Está adulterada, pois o teor de gasolina é de 30%.
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2014

A composição apresentada acima faz parte de um pedido de patente de um óleo fixo vegetal (OFV 01.2014), isolado de uma espécie amazônica. Trata-se de um produto que deverá ser licenciado para ser comercializado como desodorante natural.
Com relação às informações hipotéticas acima, julgue os itens de 57 a 62.
O óleo vegetal OFV 01.2014 poderá ser classificado como ativo desodorante caso seja comprovada a sua efetividade no controle da proliferação de bactérias residentes que causam mau odor a partir de secreções apócrinas e écrinas.- C. Certo
- E. Errado
Sobre o uso de capelas de exaustão em laboratório de Química, podemos afirmar que:
- A. devem ser usadas como uma barreira física de proteção individual no caso de reações com alto risco de explosão.
- B. devem ser usadas para armazenar reagentes irritantes, inflamáveis ou que produzem vapores tóxicos.
- C. devem ser usadas para abrigar equipamentos que emitem altos níveis de ruído durante o uso ou permanentemente, caso o equipamento seja rotineiro.
- D. devem ser usadas como exaustor, sobretudo no início da jornada de trabalho do laboratório, quando utilizadas com a janela corrediça aberta.
- E. devem ser usadas para conter e trabalhar com reações que utilizem ou produzam vapores tóxicos, irritantes ou inflamáveis, mantendo o laboratório livre de tais componentes.
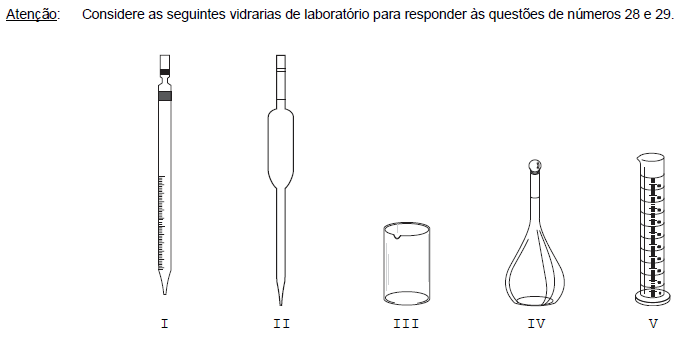 As vidrarias que permitem completar o volume de solução desejado com o solvente, no preparo de soluções de concentrações determinadas, são APENAS as
As vidrarias que permitem completar o volume de solução desejado com o solvente, no preparo de soluções de concentrações determinadas, são APENAS as
- A. I e II.
- B. III e IV.
- C. IV e V.
- D. I, II e III.
- E. III, IV e V.
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2014
O INPI recebeu o pedido de patente de uma formulação líquida emulsionada de uso cosmético cujo componente ativo é um óleo fixo natural, recém-isolado pelos pesquisadores, com propriedades hidratantes para a pele. Os autores afirmam que a formulação é bastante estável e que, além do óleo, ela apresenta uma porcentagem relativamente alta (40% v/v) de tensoativo e cotensoativo não iônicos.
Com referência a essa situação hipotética, julgue os itens a seguir.
Mesmo sem o conhecimento da constituição do óleo natural, os pesquisadores já conseguiriam prever o potencial hidratante do referido cosmético para a pele, visto que os óleos têm propriedades emolientes para o estrato córneo.- C. Certo
- E. Errado
O eletrodo indicador mais utilizado para a medida do pH é o eletrodo de vidro combinado com o eletrodo de calomelano (de referência). Sobre a medida do pH com o eletrodo de vidro combinado, podemos afirmar que:
- A. o potencial do eletrodo de calomelano varia com o tempo, por isso é necessária a calibração periódica do eletrodo de vidro combinado.
- B. por causa da grande sensibilidade, esses eletrodos podem ser utilizados para medidas de pH acima de 12, uma vez que os íons H+ estão presentes em baixas concentrações
- C. o contato direto da membrana porosa de vidro com a solução teste elimina o potencial de junção líquida, que é uma das fontes de erro comum aos eletrodos metal-íon metálico.
- D. o potencial medido deve-se ao gradiente de íons H+ através da membrana, quando o eletrodo é imerso na solução de pH desconhecido.
- E. o fluxo de elétrons responsável pela medida do potencial inicia com a reação de redução dos íons H+ (os que atravessam a membrana de vidro) a gás H2.
A medição de massa é uma atividade corriqueira que, dependendo do objetivo, requer diferentes graus de precisão. Considere as afirmativas a seguir, relativas à medição correta de 5,21 g de uma amostra de aço, cuja densidade é de 7,56 g mL-1, numa balança.
I - Tal medição requer o manuseio das amostras com pinças ou aparatos afi ns de modo a evitar o contato das mãos com o material que será pesado.
II - Tal medição requer o uso de balança calibrada com pesos padrões e nivelada.
III - Tal medição requer o uso de balança cuja escala apresente apenas uma casa decimal do grama.
Está correto o que se afirma em
- A. I, apenas
- B. III, apenas
- C. I e II, apenas
- D. II e III, apenas
- E. I, II e III
Para subir o pH da água a ser tratada é correto utilizar
- A. NaOH e NH4Cl.
- B. Na2CO3 e Ca(OH)2.
- C. NaCl e NaClO.
- D. NaCl e HCl.
- E. Al2O3 e HCl.
O papel indicador universal é composto por uma mistura de indicadores ácido-base capaz de fornecer a faixa de pH de uma solução aquosa através da mudança sutil de cor. Sobre os indicadores ácido-base e suas aplicações em titulações, assinale a alternativa INCORRETA.
- A. Devem ter faixa de viragem de cor mais próxima possível do pH do ponto final, para diminuir o erro da titulação.
- B. Devem ser usados em grande quantidade (cerca de 1 mL), para que a indicação do ponto final seja nítida e com o menor erro possível.
- C. São ácidos e bases orgânicos (por isso são fracos) que se dissociam de acordo com o pH durante a titulação.
- D. A mudança de cor ocorre porque a forma não dissociada do indicador (forma ácida) tem cor diferente da forma dissociada (forma básica).
- E. Em certos intervalos de pH, a cor resultante do indicador é combinação das cores das espécies ácida e básica, levando em conta a intensidade de cada uma.


