Questões sobre Práticas Laboratoriais em química
Lista completa de Questões sobre Práticas Laboratoriais em química para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
A destilação é um dos processos de separação mais utilizados na indústria de petróleo. A respeito dos fundamentos e da aplicabilidade da destilação, são feitas as afirmações a seguir.
I - A destilação por arraste a vapor é, em geral, utilizada para separar componentes de misturas solúveis em água.
II - A destilação fracionada não pode separar uma mistura azeotrópica porque a composição da fase líquida é igual à composição do vapor.
III - Na destilação de misturas bifásicas a pressão de vapor total acima da mistura é igual à soma das pressões de vapor dos componentes puros individuais.
IV - Na destilação fracionada, quanto menor a razão de refluxo, maior a eficiência de separação dos componentes da mistura.
Estão corretas APENAS as afirmações
- A.
I e IV
- B.
II e III
- C.
II e IV
- D.
I, II e III
- E.
I, II e IV
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Julgue os itens subseqüentes, relativos à alquimia e à química.
I Os alquimistas se empenharam na busca da cura de todos os males, procurando obter um elixir que proporcionasse um equilíbrio perfeito entre o ser humano e o universo.
II Para o pensamento alquímico, os minerais deixados em repouso, em suas matrizes tectônicas, na Mãe Terra, como embriões metálicos, acabariam tornando-se ouro após centenas de milhares de séculos. Caberia ao alquimista acelerar tal transformação.
III O pensamento alquímico dissipou-se com a ciência moderna, nada deixando à química de seu ideário.
IV Diversos processos e técnicas de manipulação da matéria, equipamentos e nomenclaturas foram herdados da alquimia pela ciência química.
A quantidade de itens certos é igual a
- A.
1.
- B.
2.
- C.
3.
- D.
4.
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
O clorofórmio, CHCl3 , empregado como solvente para produtos naturais, fumigante (para solo), anestésico e droga, é produto altamente tóxico ao organismo humano. Considerando que o valor da densidade desse produto é 1,5 g/mL a 20 ºC, calcule o volume necessário dessa substância para preparar 500 mL de uma solução com concentração em massa correspondente a 12,0 g/L e assinale a opção com a correta indicação desse volume e da vidraria que deve ser utilizada no preparo dessa solução, de forma que o erro percentual associado à medida seja o menor possível.
- A.
O volume é de 4,00 mL e deve ser medido em pipeta graduada de 5 mL, cuja menor divisão da vidraria é o 0,1 mL.
- B.
O volume é de 4,00 mL e deve ser medido em proveta de 5 mL, cuja menor divisão da vidraria é 0,5 mL.
- C.
O volume é de 9,00 mL e deve ser medido em proveta de 10 mL, cuja menor divisão é 0,5 mL.
- D.
O volume é de 9,00 mL e deve ser medido em pipeta graduada de 10 mL, cuja menor divisão é 0,1 mL.
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
A sacarose, composta por uma molécula de 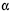 -D-glicose e uma de
-D-glicose e uma de 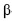 -D-frutose, tendo os átomos de carbono C1 da glicose e C2 da frutose participação na ligação glicosídica, é comumente conhecida como açúcar, sendo extraída para distribuição comercial da cana-de-açúcar (Sacharum officinarum) e da beterraba (Beta vulgaris). No estômago de mamíferos, a sacarose é digerida por hidrólise ácida, que é o mesmo processo usado, em laboratório, para se obterem glicose e frutose. Estas, resultantes da hidrólise da sacarose, são rapidamente absorvidas no intestino delgado, penetrando na corrente sanguínea. Por esses motivos, a sacarose é uma fonte de energia química rápida (com um conteúdo calórico de 17 kJ/g) e causa, logo após sua ingestão, a subida dos níveis sanguíneos de glicose. A partir do gráfico a seguir (ln k × 1/T), em que k representa a constante de velocidade da reação e T, a temperatura absoluta, é possível determinar um dos parâmetros de Arrhenius, isto é, a energia de ativação, Ea , para a hidrólise ácida da sacarose. Considere-se que a velocidade da reação dependa exclusivamente da concentração de sacarose e observe-se que dois pontos da reta são mostrados no gráfico.
-D-frutose, tendo os átomos de carbono C1 da glicose e C2 da frutose participação na ligação glicosídica, é comumente conhecida como açúcar, sendo extraída para distribuição comercial da cana-de-açúcar (Sacharum officinarum) e da beterraba (Beta vulgaris). No estômago de mamíferos, a sacarose é digerida por hidrólise ácida, que é o mesmo processo usado, em laboratório, para se obterem glicose e frutose. Estas, resultantes da hidrólise da sacarose, são rapidamente absorvidas no intestino delgado, penetrando na corrente sanguínea. Por esses motivos, a sacarose é uma fonte de energia química rápida (com um conteúdo calórico de 17 kJ/g) e causa, logo após sua ingestão, a subida dos níveis sanguíneos de glicose. A partir do gráfico a seguir (ln k × 1/T), em que k representa a constante de velocidade da reação e T, a temperatura absoluta, é possível determinar um dos parâmetros de Arrhenius, isto é, a energia de ativação, Ea , para a hidrólise ácida da sacarose. Considere-se que a velocidade da reação dependa exclusivamente da concentração de sacarose e observe-se que dois pontos da reta são mostrados no gráfico.
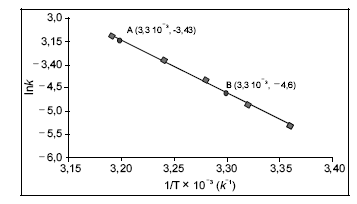
Considerando-se que a constante universal dos gases vale 8,3145 J·K-1· mol-1 , é correto concluir que o valor da energia de ativação da hidrólise ácida da sacarose é
- A.
inferior a 80 kJ/mol.
- B.
superior ou igual a 80 kJ/mol e inferior a 90 kJ/mol.
- C.
superior ou igual a 90 kJ/mol e inferior a 100 kJ/mol.
- D.
superior 100 kJ/mol.
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
No método de titulação, a solução cuja concentração é conhecida, chama-se solução-padrão. Para que uma substância seja considerada um padrão primário, ela deve atender a alguns requisitos necessários e outros desejáveis. É condição sine qua non, por exemplo, que a substância tenha alta pureza. Entre as condições desejáveis, está a de que ela deve ter elevada massa molar. Assinale a opção em se justifica a necessidade de o padrão primário atender a esse critério desejável.
- A.
Substâncias de elevada massa molar são geralmente de fácil purificação.
- B.
Substâncias de elevada massa molar reagem em uma proporção estequiométrica.
- C.
Substâncias de elevada massa molar minimizam erros de pesagem.
- D.
Tais substâncias são, em geral, higroscópicas.
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008

O eletrodo de vidro, mostrado na figura acima, é um bulbo, construído em vidro especial, que contém uma solução de concentração fixa (0,1 mol/L ou 1 mol/L) de ácido clorídrico (HCl) ou uma solução tamponada de cloreto em contato com o eletrodo de referência interno, normalmente constituído de prata revestida de cloreto de prata, o que assegura um potencial constante na interface entre a superfície interna do sensor e o eletrólito. O elemento sensor do eletrodo, situado na extremidade do bulbo, é constituído por uma membrana de vidro que, hidratada, forma uma camada de gel, externa, seletiva de íon hidrogênio. Essa seleção é, de fato, uma troca de íons sódio por íons hidrogênio, os quais formam uma camada sobre a superfície do sensor. Além disso, ocorrem forças de repulsão de ânions por parte do silicato, negativamente carregado, que está fixo no sensor. Ocorre, na camada externa do sensor, a geração de um potencial que é função da atividade do íon hidrogênio na solução. Com relação ao eletrodo de vidro, assinale a opção incorreta.
- A.
Eletrodos de vidro estão sujeitos tanto a erros ácidos quanto a erros básicos.
- B.
Íons hidrogênio migram através da membrana de vidro para produzir a diferença de potencial.
- C.
Eletrodos de vidro são suscetíveis a diminuição da sensibilidade, resposta lenta e erros de leitura, devido a riscos, arranhões, deterioração ou acumulação de resíduos sobre a superfície do vidro.
- D.
O "rejuvenescimento" de eletrodos de vidro pode ser feito por meio do tratamento cíclico ácido-álcali, que consiste na imersão, por sucessivas vezes, do sensor em soluções ácida e básica.
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Os métodos potenciométricos analíticos são baseados em medidas de potencial de células eletroquímicas. Um desses métodos é a titulação potenciométrica, que consiste no acompanhamento dos vários estágios e na determinação do ponto final de um processo de titulação por intermédio da medida de pH. Nesse método, o ponto de equivalência é revelado por uma abrupta modificação do pH. Em geral, é necessário adotar um tratamento geométrico para fixar, com exatidão, o ponto final da titulação. Resultados mais satisfatórios são obtidos, entretanto, quando se empregam métodos matemáticos para localizar o ponto final. Assinale a opção em que o gráfico corresponde à 1.ª derivada da curva de titulação (pH versus volume de titulante adicionado).
- A.

- B.

- C.

- D.

Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
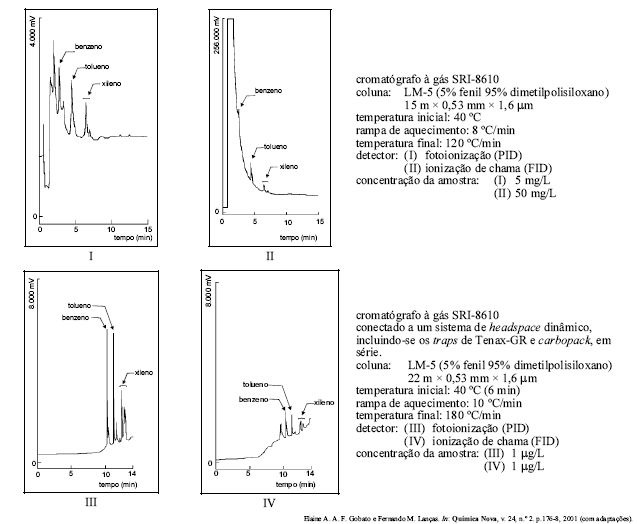
Entre os métodos modernos de análise química, a cromatografia ocupa lugar de merecido destaque no que se refere à separação, identificação e quantificação de espécies químicas. Soluções contendo benzeno, tolueno e xileno foram preparadas em metanol e injetadas em um cromatógrafo a gás modelo SRI-8610. As figuras acima mostram alguns cromatogramas obtidos por essa técnica, seguidos de informações a respeito das condições de corrida cromatográficas. Com base nas figuras e nas informações apresentadas, assinale a opção correta.
- A.
O sinal obtido pelo detector de fotoionização (PID) foi maior que o obtido pelo detector de ionização de chama (FID), para amostras com a mesma concentração, por ser aquele mais sensível que este.
- B.
O pico que antecede o do benzeno, nos cromatogramas I e II, é relativo a interferentes da amostra injetada.
- C.
C O cromatograma II teria seus picos mais bem resolvidos se a concentração da amostra fosse de 5 mg/L.
- D.
Os cromatogramas III e IV apresentam picos mais bem resolvidos devido ao fato de a técnica de headspace ser apropriada para analisar compostos com elevadas concentrações.
Química - Práticas Laboratoriais em química - FUNRIO Fundação de Apoio a Pesquisa, Ensino e Assistência (FUNRIO) - 2008
O índice de Wobbe tem importância fundamental nos estudos de combustão de gases. É expresso como:

onde PCS é poder calorífico superior e PCI é poder calorífico inferior, ambos em unidade de energia por unidade de volume. O índice de Wobbe pode, ainda, ser classificado como superior ou inferior, dependendo do poder calorífico utilizado.
Com base nessas informações, pode-se afirmar, que o referido índice:
- A.
pode apresentar seus valores expressos em megajoules por metro cúbico de gás seco, sob condições de referência (MJ.m-3 ).
- B.
pode apresentar seus valores expressos em megajoules vezes kilogramas de gás seco (MJ.kg).
- C.
pode apresentar seus valores expressos em kcal.kg-0,5.m-1,5, sob condições de referência.
- D.
pode apresentar seus valores expressos em quilocalorias vezes gramas de gás seco (kcal.g).
- E.
é adimensional por tratar-se de um número índice.
Química - Práticas Laboratoriais em química - FUNRIO Fundação de Apoio a Pesquisa, Ensino e Assistência (FUNRIO) - 2008
Não se deve secar vidrarias de precisão na estufa, sob pena de se perder a calibração do instrumento.
Dentre as alternativas abaixo, aquela que contém uma vidraria de precisão é
- A.
balão de fundo redondo.
- B.
becher
- C.
bureta.
- D.
tubo de ensaio.
- E.
condensador.


