Questões sobre Reações, Soluções e Transformações Químicas
Lista completa de Questões sobre Reações, Soluções e Transformações Químicas para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
Uma das determinações clássicas da volumetria é a determinação da dureza da água. Esta é geralmente devida à presença de sais de cálcio e magnésio dissolvidos e pode ser determinada por titulação complexométrica com o ácido etilenodiaminotetracético (EDTA). Com relação a essa determinação, às titulações que utilizam EDTA e à volumetria de forma geral, considerando que a sigla EGTA refere-se ao ácido etilenoglicol-bis(2- aminoetiléter)-N,N,N',N'-tetracético, julgue os itens a seguir.
Caso haja magnésio na amostra, pode-se determinar com sucesso a dureza do cálcio e a dureza do magnésio, separadamente, fazendo-se duas titulações com rigoroso controle do pH.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
A crescente preocupação mundial com o esgotamento das reservas petrolíferas tem gerado um grande número de pesquisas para a obtenção de energia a partir de outras fontes. Uma dessas alternativas, que está em desenvolvimento, é a utilização de hidrogênio gerado a partir da oxidação do metano, segundo a equação química a seguir.
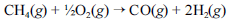
Na tabela a seguir, são fornecidas as entalpias de formação do metano e do monóxido de carbono.

A partir dessas informações, julgue os itens seguintes.
A entalpia da oxidação do metano apresentada é igual à soma da entalpia dos produtos e a dos reagentes dessa reação
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
A crescente preocupação mundial com o esgotamento das reservas petrolíferas tem gerado um grande número de pesquisas para a obtenção de energia a partir de outras fontes. Uma dessas alternativas, que está em desenvolvimento, é a utilização de hidrogênio gerado a partir da oxidação do metano, segundo a equação química a seguir.
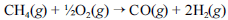
Na tabela a seguir, são fornecidas as entalpias de formação do metano e do monóxido de carbono.

A partir dessas informações, julgue os itens seguintes.
Considerando-se que, à temperatura de 1.300 K e a 1 atm, a entalpia da reação apresentada seja igual a -22 kJ, então é correto concluir que, quanto maior a temperatura, maior é o calor liberado por essa reação, mantida a pressão constante.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
Uma das determinações clássicas da volumetria é a determinação da dureza da água. Esta é geralmente devida à presença de sais de cálcio e magnésio dissolvidos e pode ser determinada por titulação complexométrica com o ácido etilenodiaminotetracético (EDTA). Com relação a essa determinação, às titulações que utilizam EDTA e à volumetria de forma geral, considerando que a sigla EGTA refere-se ao ácido etilenoglicol-bis(2- aminoetiléter)-N,N,N',N'-tetracético, julgue os itens a seguir.
Considerando que o magnésio está ausente na amostra analisada e que esta foi titulada diretamente, ou seja, que não há fator de diluição, a seguinte expressão pode ser usada corretamente para se calcular a dureza total: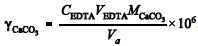 , em que
, em que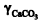 é a dureza total, em µg/L de CaCO 3 ,
é a dureza total, em µg/L de CaCO 3 ,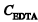 é a concentração de EDTA, em mol/L,
é a concentração de EDTA, em mol/L,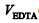 é o volume de solução de EDTA, em mL, gasto para virar o indicador,
é o volume de solução de EDTA, em mL, gasto para virar o indicador,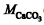 é a massa molar do
é a massa molar do 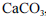 , em g/mol, e V a é o volume da alíquota tomada para análise, em mL.
, em g/mol, e V a é o volume da alíquota tomada para análise, em mL.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
A crescente preocupação mundial com o esgotamento das reservas petrolíferas tem gerado um grande número de pesquisas para a obtenção de energia a partir de outras fontes. Uma dessas alternativas, que está em desenvolvimento, é a utilização de hidrogênio gerado a partir da oxidação do metano, segundo a equação química a seguir.
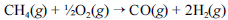
Na tabela a seguir, são fornecidas as entalpias de formação do metano e do monóxido de carbono.

A partir dessas informações, julgue os itens seguintes.
A entalpia da reação apresentada, a 25º C e 1 atm, para a formação de 10 mols de hidrogênio, é igual a -35,68 kJ.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
A crescente preocupação mundial com o esgotamento das reservas petrolíferas tem gerado um grande número de pesquisas para a obtenção de energia a partir de outras fontes. Uma dessas alternativas, que está em desenvolvimento, é a utilização de hidrogênio gerado a partir da oxidação do metano, segundo a equação química a seguir.
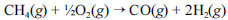
Na tabela a seguir, são fornecidas as entalpias de formação do metano e do monóxido de carbono.

A partir dessas informações, julgue os itens seguintes.
Em qualquer instante em que a reação apresentada no texto se processe, a soma das massas dos produtos e dos reagentes é constante.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
O gás natural é composto por gases inorgânicos e hidrocarbonetos saturados, predominando o metano e, em menores quantidades, o propano e o butano. O gás liqüefeito de petróleo (GLP), mais largamente conhecido como gás de cozinha é constituído basicamente de butano, é normalmente comercializado em botijões no estado líquido, tornando-se gasoso à pressão atmosférica e temperatura ambiente na hora de sua utilização em fogão. Esse gás é incolor e inodoro e, por questões de segurança, o gás natural comercializado é odorizado com um composto de enxofre. Com relação a essas informações, julgue os itens seguintes.
Na combustão do butano, o hidrocarboneto é o agente redutor.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
O gás natural é composto por gases inorgânicos e hidrocarbonetos saturados, predominando o metano e, em menores quantidades, o propano e o butano. O gás liqüefeito de petróleo (GLP), mais largamente conhecido como gás de cozinha é constituído basicamente de butano, é normalmente comercializado em botijões no estado líquido, tornando-se gasoso à pressão atmosférica e temperatura ambiente na hora de sua utilização em fogão. Esse gás é incolor e inodoro e, por questões de segurança, o gás natural comercializado é odorizado com um composto de enxofre. Com relação a essas informações, julgue os itens seguintes.
A pressão total exercida pelo gás natural é igual à soma das pressões parciais dos gases que o compõem.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
Alcoóis, sobretudo o metanol e o etanol, têm sido utilizados para substituir combustíveis líquidos. Eles podem ser diretamente queimados como combustíveis para gerar energia. No entanto, eles são usados também indiretamente. Por exemplo, o metanol é empregado para a formação de gasolina em uma reação catalisada por zeólitas, que são aluminossilicatos. As zeólitas são sólidos resultantes da substituição de alguns íons de Si +4 dos silicatos (óxidos de silício) por íons Al +3 . Sua função como catalisador está relacionada à sua capacidade em liberar íons H + . Considerando essas informações, julgue os itens seguintes.
Considerando uma solução formada por 2% em massa de etanol em água, que a massa molecular do etanol é de 46 g/mol e a densidade da solução é a mesma da água, que é igual a 1 g/mL, então, a concentração de etanol nessa solução é inferior a 4,5 × 10 -4 mol/L.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
Alcoóis, sobretudo o metanol e o etanol, têm sido utilizados para substituir combustíveis líquidos. Eles podem ser diretamente queimados como combustíveis para gerar energia. No entanto, eles são usados também indiretamente. Por exemplo, o metanol é empregado para a formação de gasolina em uma reação catalisada por zeólitas, que são aluminossilicatos. As zeólitas são sólidos resultantes da substituição de alguns íons de Si +4 dos silicatos (óxidos de silício) por íons Al +3 . Sua função como catalisador está relacionada à sua capacidade em liberar íons H + . Considerando essas informações, julgue os itens seguintes.
A pressão exercida sobre uma solução de 98% em massa de etanol e 2% em massa de água deve ser reduzida para que a temperatura de fusão da solução seja igual à temperatura de fusão do etanol puro.
- C. Certo
- E. Errado


