Questões sobre Reações, Soluções e Transformações Químicas
Lista completa de Questões sobre Reações, Soluções e Transformações Químicas para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
A massa, em gramas, de uma solução de NaCl a 5% em peso, para fornecer 3,2 g de NaCl, é de:
Dados: Na = 23 e Cl = 35,5
- A. 59.
- B. 60.
- C. 62.
- D. 64.
- E. 66.
Um material bastante empregado na confecção de roupas antichama, como as utilizadas por bombeiros e pilotos de Fórmula 1, é o polímero Nomex, cuja estrutura é mostrada abaixo.

Com base nas informações acima, julgue os próximos itens.
Na combustão completa de 1 mol do monômero 2, a quantidade de água formada é igual a 1 mol.- C. Certo
- E. Errado
Em setembro de 2013, ocorreu, em Santa Catarina, uma grande explosão, seguida de incêndio, em um depósito de fertilizantes à base de NH4NO3. Devido ao acidente, uma grande quantidade de gases tóxicos foi liberada na atmosfera, expondo a população e os bombeiros que trabalharam no controle do incêndio a riscos de intoxicação. Nesse sentido, considere que a decomposição do NH4NO3 ocorra por meio da reação abaixo apresentada, que não está balanceada.

Com base nessas informações, julgue os itens que se seguem, considerando que as massas molares do N, do H e do O sejam iguais a 14, 1 e 16 g/mol, respectivamente.
A reação de decomposição do NH4NO3 (s) está corretamente balanceada na equação
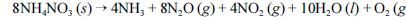
- C. Certo
- E. Errado
Em setembro de 2013, ocorreu, em Santa Catarina, uma grande explosão, seguida de incêndio, em um depósito de fertilizantes à base de NH4NO3. Devido ao acidente, uma grande quantidade de gases tóxicos foi liberada na atmosfera, expondo a população e os bombeiros que trabalharam no controle do incêndio a riscos de intoxicação. Nesse sentido, considere que a decomposição do NH4NO3 ocorra por meio da reação abaixo apresentada, que não está balanceada.
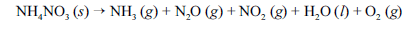
Com base nessas informações, julgue os itens que se seguem, considerando que as massas molares do N, do H e do O sejam iguais a 14, 1 e 16 g/mol, respectivamente.
O NH4NO3, um sal cuja nomenclatura é nitrato de amônio, pode ser sintetizado a partir da reação de neutralização do ácido nítrico com amônia.- C. Certo
- E. Errado
Em setembro de 2013, ocorreu, em Santa Catarina, uma grande explosão, seguida de incêndio, em um depósito de fertilizantes à base de NH4NO3. Devido ao acidente, uma grande quantidade de gases tóxicos foi liberada na atmosfera, expondo a população e os bombeiros que trabalharam no controle do incêndio a riscos de intoxicação. Nesse sentido, considere que a decomposição do NH4NO3 ocorra por meio da reação abaixo apresentada, que não está balanceada.

Com base nessas informações, julgue os itens que se seguem, considerando que as massas molares do N, do H e do O sejam iguais a 14, 1 e 16 g/mol, respectivamente.
Considere que 3,0 L de uma solução de NH4NO3 tenham sido preparados pela dissolução de 8,0 g do composto em quantidade suficiente de água. Nessa situação, é correto afirmar que a concentração da solução preparada é superior a 0,030 mol/L.- C. Certo
- E. Errado
Metais pirofóricos, como sódio (Na), zinco (Zn), magnésio (Mg), potássio (K), bário (Ba), cálcio (Ca), alumínio (Al), zircônio (Zr) e titânio (Ti), podem sofrer ignição instantânea ao entrarem em contato com umidade ou oxigênio e causar incêndios classificados como de classe D. Portanto esses metais devem ser estocados em atmosfera inerte ou em óleos minerais. O potássio, por exemplo, reage explosivamente com água, devido à liberação de hidrogênio. O bário, ao ser queimado, forma chamas coloridas de altíssimas temperaturas. As equações químicas não balanceadas, apresentadas a seguir, ilustram esses processos.
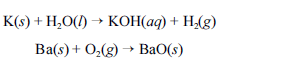
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
Entre os metais citados no texto, aquele que apresenta maior energia de ionização é o alumínio.- C. Certo
- E. Errado
Metais pirofóricos, como sódio (Na), zinco (Zn), magnésio (Mg), potássio (K), bário (Ba), cálcio (Ca), alumínio (Al), zircônio (Zr) e titânio (Ti), podem sofrer ignição instantânea ao entrarem em contato com umidade ou oxigênio e causar incêndios classificados como de classe D. Portanto esses metais devem ser estocados em atmosfera inerte ou em óleos minerais. O potássio, por exemplo, reage explosivamente com água, devido à liberação de hidrogênio. O bário, ao ser queimado, forma chamas coloridas de altíssimas temperaturas. As equações químicas não balanceadas, apresentadas a seguir, ilustram esses processos.
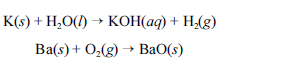
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
A concepção de átomo proposta por Rutherford permite explicar a coloração da chama emitida no processo de combustão do bário.- C. Certo
- E. Errado
Metais pirofóricos, como sódio (Na), zinco (Zn), magnésio (Mg), potássio (K), bário (Ba), cálcio (Ca), alumínio (Al), zircônio (Zr) e titânio (Ti), podem sofrer ignição instantânea ao entrarem em contato com umidade ou oxigênio e causar incêndios classificados como de classe D. Portanto esses metais devem ser estocados em atmosfera inerte ou em óleos minerais. O potássio, por exemplo, reage explosivamente com água, devido à liberação de hidrogênio. O bário, ao ser queimado, forma chamas coloridas de altíssimas temperaturas. As equações químicas não balanceadas, apresentadas a seguir, ilustram esses processos.

Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
A reação do potássio metálico com água forma dois produtos, um de natureza iônica e outro de natureza molecular, os quais apresentam ligações covalentes em sua estrutura.- C. Certo
- E. Errado
Metais pirofóricos, como sódio (Na), zinco (Zn), magnésio (Mg), potássio (K), bário (Ba), cálcio (Ca), alumínio (Al), zircônio (Zr) e titânio (Ti), podem sofrer ignição instantânea ao entrarem em contato com umidade ou oxigênio e causar incêndios classificados como de classe D. Portanto esses metais devem ser estocados em atmosfera inerte ou em óleos minerais. O potássio, por exemplo, reage explosivamente com água, devido à liberação de hidrogênio. O bário, ao ser queimado, forma chamas coloridas de altíssimas temperaturas. As equações químicas não balanceadas, apresentadas a seguir, ilustram esses processos.
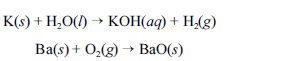
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
Considerando-se o valor aproximado de 6 × 1023 mol-1 para a constante de Avogadro, infere-se que, quando são colocados 1,8 × 1024 átomos de bário e 2 mols de gás oxigênio em reação, formam-se mais de 400 g de BaO.- C. Certo
- E. Errado
Metais pirofóricos, como sódio (Na), zinco (Zn), magnésio (Mg), potássio (K), bário (Ba), cálcio (Ca), alumínio (Al), zircônio (Zr) e titânio (Ti), podem sofrer ignição instantânea ao entrarem em contato com umidade ou oxigênio e causar incêndios classificados como de classe D. Portanto esses metais devem ser estocados em atmosfera inerte ou em óleos minerais. O potássio, por exemplo, reage explosivamente com água, devido à liberação de hidrogênio. O bário, ao ser queimado, forma chamas coloridas de altíssimas temperaturas. As equações químicas não balanceadas, apresentadas a seguir, ilustram esses processos.

Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
O estado de oxidação do bário é mais reduzido na forma metálica desse elemento que na estrutura da substância que resulta como produto de sua queima.- C. Certo
- E. Errado


