Questões de Química da Escola de Administração Fazendária (ESAF)
Lista completa de Questões de Química da Escola de Administração Fazendária (ESAF) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.

- A.
I.
- B.
II.
- C.
I e II.
- D.
II e III.
- E.
I, II e III.
Química - Reações, Soluções e Transformações Químicas - Escola de Administração Fazendária (ESAF) - 2012

- A.
667 ºC
- B.
723 ºC
- C.
790 ºC
- D.
823 ºC
- E.
953 ºC
Química - Reações, Soluções e Transformações Químicas - Escola de Administração Fazendária (ESAF) - 2012

- A.
- 175 KJ
- B.
- 349 KJ
- C.
- 422 KJ
- D.
- 520 KJ
- E.
- 1040 KJ
Em relação às propriedades termodinâmicas e à espontaneidade das transformações, analise as assertivas a seguir.
I. Entalpia (H) é uma função de estado que mede a quantidade de calor absorvido ou liberado em qualquer transformação.
II. Entropia (S) é uma função de estado que mede o grau de desordem dos diferentes estados da matéria em uma transformação espontânea.
III. A variação de energia livre de Gibbs (ΔG) é uma medida da entropia total de um sistema, quando a temperatura e a pressão são constantes. As transformações espontâneas, nessas condições, são acompanhadas pelo aumento da energia livre.
IV. Sabendo que a variação de energia livre de Gibbs (ΔG) é dada pela expressão ΔG= ΔH TΔS, uma transformação exotérmica (ΔH<0) acompanhada pela diminuição da entropia (ΔS<0) não pode ser espontânea.
É(São) correta(s) apenas a(s) assertiva(s)
- A.
I.
- B.
II.
- C.
I e II.
- D.
II e III.
- E.
I, II e IV.
Química - Reações, Soluções e Transformações Químicas - Escola de Administração Fazendária (ESAF) - 2012
O Monóxido de Carbono (CO) é um gás levemente inflamável, incolor, inodoro e muito perigoso devido a sua grande toxicidade. Ele é um agente redutor, retirando oxigênio de muitos compostos em processos industriais (formando CO2). Qual o volume máximo de CO2 a 1 atm e 32ºC que pode ser produzido reagindo-se 1 L de CO a 1 atm e 27ºC com 2 L de O2 a 0,5 atm e 27ºC ?
Dado: R = 0,082 atm.L.mol-1.K-1
- A.
0,5 L
- B.
1 L
- C.
1,5 L
- D.
2,0 L
- E.
2,5 L
A Lei dos Gases Ideais é uma equação de estado que descreve a resposta de um gás ideal a mudanças de pressão, volume, temperatura e quantidade de moléculas. Entretanto, diversos processos industriais empregam determinadas condições de pressão e temperatura, as quais a lei dos gases ideais não são exatamente obedecidas. Nesse caso, o comportamento se assemelha ao dos gases reais. Em relação aos gases ideais e reais, analise as assertivas a seguir.
I. A lei dos gases ideais representada pela expressão PV= nRT pode ser usada para gases reais em baixas pressões.
II. O fator de compressão, Z, de um gás é a razão do volume molar do gás e o volume molar de um gás ideal nas mesmas condições. Portanto um gás ideal deveria apresentar Z=0, pois não há qualquer interação entre suas moléculas.
III. A equação do virial é uma equação geral usada para descrever gases reais e leva em consideração as forças de atração e repulsão intermoleculares.
IV. A equação de van der Waals é uma equação de estado aproximada de um gás real, que independente da temperatura, inclui parâmetros relacionados apenas com as forças de atração.
É(São) correta(s) apenas a(s) assertiva(s)
- A.
I.
- B.
III.
- C.
I e III.
- D.
II e IV.
- E.
I, III e IV.

- A.
16,8 g.
- B.
20,8 g.
- C.
24,8 g.
- D.
31,8 g.
- E.
38,8 g.

- A.
160,0 g.
- B.
184,5 g.
- C.
196,5 g.
- D.
210,5 g.
- E.
224,5 g.
Química - Reações, Soluções e Transformações Químicas - Escola de Administração Fazendária (ESAF) - 2012
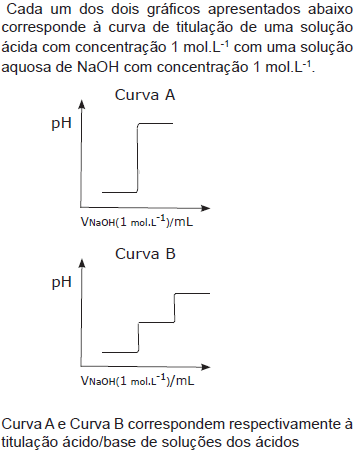
- A.
H2SO4 e H3PO4.
- B.
HNO3 e H2SO4.
- C.
H2SO4 e HCl.
- D.
H3PO4 e HCl.
- E.
HCl e H3PO4.

- A.
1-pentino < n-butiraldeído < n-butironitrila.
- B.
n-butironitrila < n-butiraldeído < 1-pentino.
- C.
1-pentino < n-butironitrila < n-butiraldeído.
- D.
n-butiraldeído < 1-pentino < n-butironitrila.
- E.
n-butironitrila < 1-pentino < n-butiraldeído.


