Questões de Química da Fundação de Amparo e Desenvolvimento da Pesquisa (FADESP)
Lista completa de Questões de Química da Fundação de Amparo e Desenvolvimento da Pesquisa (FADESP) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Fundação de Amparo e Desenvolvimento da Pesquisa (FADESP) - 2008
A conversão de monóxido de carbono em dióxido de carbono, na presença de catalisador Cu-Zn, como representado na equação química abaixo, é conhecida como reação de deslocamento porque converte CO(g) em CO2(g):

Se a entalpia %u0394H) e a entropia %u0394S) dessa reação a 298K são, respectivamente, -41,2 kJ e -42,0 J/K.mol, então, a energia livre %u0394G), em Joule, dessa reação nessa temperatura será aproximadamente igual a
- A.

- B. +2,87 x 104.
- C. +1,43 x 103.
- D. -2,87 x 104.
Química - Reações, Soluções e Transformações Químicas - Fundação de Amparo e Desenvolvimento da Pesquisa (FADESP) - 2008
Considerando-se uma parafina CnH2n+2, onde n é um número inteiro), o composto de menor massa molecular que pode apresentar um isômero com atividade ótica terá a seguinte fórmula molecular:
- A. C3H8.
- B. C5H12.
- C. C7H16.
- D. C9H20.
Química - Reações, Soluções e Transformações Químicas - Fundação de Amparo e Desenvolvimento da Pesquisa (FADESP) - 2008
Considere-se uma pilha composta por uma ponte salina solução aquosa de KCl), um eletrodo de estanho metálico mergulhado em uma solução aquosa 1 molar de SnCl2 e um eletrodo de prata metálica mergulhado em uma solução aquosa de AgCl, além de um contato elétrico entre os dois eletrodos. Sabe-se ainda que Ag+/Ag, E0 = 0,80 V e Sn2+/Sn, E0 = - 0,14 V. Então, o a)
- A. função da ponte salina é manter o equilíbrio iônico nos dois eletrodos.
- B. eletrodo de estanho atuará como catodo, sofrendo oxidação.
- C. fluxo de elétrons será em direção ao eletrodo de estanho.
- D. força eletromotriz da pilha, nas condições padrão, será 0,66 V.
Química - Reações, Soluções e Transformações Químicas - Fundação de Amparo e Desenvolvimento da Pesquisa (FADESP) - 2008
Abaixo, são dadas as fórmulas químicas de algumas substâncias orgânicas:

Para essas substâncias, a ordem crescente de aumento de temperatura de ebulição é:
- A. III < V < II < I < IV.
- B. I < II < III < IV < V.
- C. III < II < V < IV < I.
- D. II < V < III < I < IV.
Química - Reações, Soluções e Transformações Químicas - Fundação de Amparo e Desenvolvimento da Pesquisa (FADESP) - 2008
Sabe-se que H2O2 / H2O, E0 = 1,77 V e que I2 / I-, E0 = 0,535 V. Então, atuará espontaneamente como agente oxidante a espécie
- A. I2
- B. H2O.
- C. I-
- D. H2O2.
Química - Reações, Soluções e Transformações Químicas - Fundação de Amparo e Desenvolvimento da Pesquisa (FADESP) - 2008
Uma solução de CrCl2 é empregada num processo de cromação de um objeto metálico cuja massa antes era 1000 g e depois de transcorridos 40 minutos do processo passou a ser 1010 g. Sabendo-se que 1 Faraday = 96.500 Coulomb, pode-se afirmar que a corrente i), em ampère, utilizada nesse processo foi de aproximadamente
- A. 7,7.
- B. 15,5.
- C. 464.
- D. 928.
Química - Reações, Soluções e Transformações Químicas - Fundação de Amparo e Desenvolvimento da Pesquisa (FADESP) - 2008
Dado que Kw = 1,0 × 10-14 e log 2,5 = 0,4, pode-se afirmar que uma solução aquosa 2 x10-3 M de Ba OH)2 apresenta
- A. concentração de íons hidroxila igual a 0,002 mol.L-1.
- B. pOH aproximadamente 11,6.
- C. pH aproximadamente 11,6.
- D. Kb aproximadamente 1,0 × 10-12.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação de Amparo e Desenvolvimento da Pesquisa (FADESP) - 2008
O grau de ionização percentual de um ácido fraco monoprótico Ka=1 x 10-10) em uma solução 0,01 molar será de aproximadamente
- A. 1 x 10-4.
- B. 3,2 x 10-3.
- C. 0,10.
- D. 0,32.
Química - Reações, Soluções e Transformações Químicas - Fundação de Amparo e Desenvolvimento da Pesquisa (FADESP) - 2008
Em um sistema com volume constante de 1,5 litros, estão presentes, no equilíbrio, 4,5 mols de N2, 7,0 mols de O2 e 0,15 mols de NO2, conforme representado na equação química:
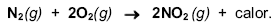
Nessas condições, o valor da constante de equilíbrio Kc) é aproximadamente
- A. 1,0 × 10-4.
- B. 1,5 × 10-4.
- C. 4,8 × 10-3.
- D. 7,1 × 10-3.
Química - Reações, Soluções e Transformações Químicas - Fundação de Amparo e Desenvolvimento da Pesquisa (FADESP) - 2008
O produto da reação do composto 2-propanol, em solução alcalina de KMnO4, tem fórmula molecular C3H6O. Esse composto é o a)
- A. propan-2-ona.
- B. 2-Propen-1-ol.
- C. propanal
- D. oxitano.


