Questões de Química da Fundação Professor Carlos Augusto Bittencourt (FUNCAB)
Lista completa de Questões de Química da Fundação Professor Carlos Augusto Bittencourt (FUNCAB) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Fundação Professor Carlos Augusto Bittencourt (FUNCAB) - 2014
As impressões digitais estão entre as principais evidências encontradas em locais de crimes. Elas são formadas pela transferência de substâncias produzidas pela transpiração e secreções sebáceas, além de água, eletrólitos e biomoléculas, em especial, aminoácidos e ácidos graxos. Para a revelação das impressões latentes, os peritos criminais fazem uso de diversos reagentes químicos.
Indique a opção que apresenta a correlação INCORRETAentre o reagente químico e a substância com que este reage, respectivamente:- A. Cianoacrilato / Água
- B. Nitrato de prata / Cloreto
- C. Iodo / Ácidos graxos insaturados
- D. Ninidrina / a-amino ácidos
- E. Cloreto de cobalto / Gorduras
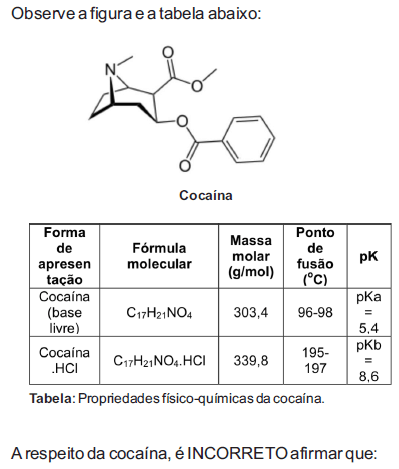
- A. o nome IUPAC da cocaína é éster metílico do ácido [1R-(exo,exo)]-3-(benzoiloxi)-8-metil-8- azabiciclo[3.2.1]octano-2-carboxílico.
- B. a cocaína na forma de base livre é muito mais suscetível ao processo de hidrólise quando comparada ao sal cloridrato (mais estável).
- C. a cocaína é uma base fraca, capaz de reagir com soluções aquosas de ácidos orgânicos ou inorgânicos formando sais.
- D. a cocaína na forma de sal dificilmente é convertida embase livre pela adição de bases inorgânicas.
- E. a cocaína na forma de base livre pode ser convertida em cloridrato de cocaína com a adição de ácido clorídrico.
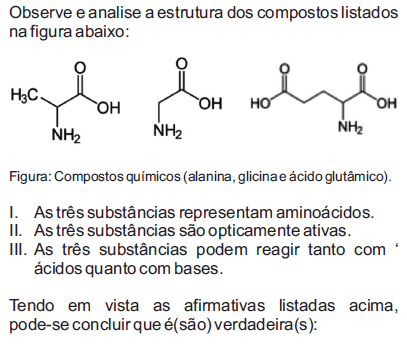
- A. I, apenas.
- B. II, apenas.
- C. III, apenas.
- D. I e III, apenas.
- E. I e II, apenas.
Química - Práticas Laboratoriais em química - Fundação Professor Carlos Augusto Bittencourt (FUNCAB) - 2014
Uma análise química é o conjunto de técnicas de laboratório utilizado na identificação das espécies químicas e na determinação de informações químicas ou físicas sobre uma amostra. No que diz respeito à preparação de uma amostra, analise as afirmativas a seguir:
I. A amostragem é o processo usado para coleta de uma amostra representativa para análise. II. Materiais heterogêneos irão sempre produzir amostras heterogêneas para análise também, tendo, obrigatoriamente, a mesma composição do material. III. A preparação de uma amostra é o processo pelo qual se converte uma amostra bruta em uma amostra de laboratório homogênea. IV. Aamostra bruta tem que ser representativa de um lote, e sua escolha deve ser crítica para que a análise seja válida. Estão corretas apenas as afirmativas:- A. I, II e III.
- B. I, III e IV.
- C. II, III e IV.
- D. I, II e IV.
- E. I e IV.

- A. I, II e III.
- B. I, III e IV.
- C. II, III e IV.
- D. I, II e IV.
- E. I e II.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação Professor Carlos Augusto Bittencourt (FUNCAB) - 2014
O fósforo é o 12º elemento mais abundante na crosta terrestre, representando aproximadamente 0,12%. Devido à alta reatividade, não ocorre livre na natureza, sendo comum encontrá-lo na forma de fosfatos em rochas que se dissolvem com a chuva, sendo levados até os rios e mares. Identifique, entre as opções abaixo, a fórmula do composto no qual o fósforo está no maior estado de oxidação.
- A. H3PO3
- B. H2PO3
- C. H3PO2
- D. H4P2O5
- E. HPO3
Química - Reações, Soluções e Transformações Químicas - Fundação Professor Carlos Augusto Bittencourt (FUNCAB) - 2014
Para calibração de um método fotométrico com a finalidade de determinar a quantidade de sódio em uma amostra, foi necessário preparar uma solução padrão de Na+ (0,0100 mol/L). Dentre as alternativas abaixo, qual delas indica o volume (em litros) dessa solução padrão previamente preparada necessário para produzir um volume de 50,00 mL de uma solução de Na+ (0,00500 mol/L)?
- A. 0,0025 L
- B. 0,025 L
- C. 25,0 L
- D. 0,01 L
- E. 0,100 L
Química - Reações, Soluções e Transformações Químicas - Fundação Professor Carlos Augusto Bittencourt (FUNCAB) - 2014
Um perito oficial dissolveu certa quantidade de um sal em solvente e, por alguma perturbação, parte do sal se depositou, produzindo uma solução. Pode-se considerar nominalmente essa solução como:
- A. saturada com corpo de fundo.
- B. supersaturada com corpo de fundo.
- C. insaturada.
- D. supersaturada sem corpo de fundo.
- E. saturada sem corpo de fundo.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação Professor Carlos Augusto Bittencourt (FUNCAB) - 2014
Os íons são estruturas eletricamente carregadas. Essas estruturas são positivas quando há perda de elétrons e são negativas quando há ganho. Considere um íon de carga 2+ cujo número de prótons é a metade do seu número de massa, que é 40. Com base nessas informações, pode-se afirmar que a distribuição eletrônica para esse íon será:
- A. 1s2 2s2 2p6 3s2 3p4 4s2 3d2
- B. 1s2 2s2 2p6 3s2 3p4 4s2
- C. 1s2 2s2 2p6 3s2 3p6
- D. 1s2 2s2 2p6 3s2 3p6 4s2
- E. 1s2 2s2 2p6 3s2 3p6 4s2 3d2
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação Professor Carlos Augusto Bittencourt (FUNCAB) - 2014
Vários estudiosos tentaram reunir os elementos químicos de forma organizada, porém, apenas o trabalho de Dimitri Mendeleev (1869) alcançou real destaque e é a base da classificação moderna dos elementos na tabela periódica. Atualmente, os elementos químicos estão dispostos de acordo com os valores crescentes de:
- A. número de massa.
- B. unidade de massa atômica.
- C. número de avogadro.
- D. número atômico.
- E. número de neutrons.


