Questões de Química da Fundação Universa (FUNIVERSA)
Lista completa de Questões de Química da Fundação Universa (FUNIVERSA) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação Universa (FUNIVERSA) - 2010
O modelo de repulsão de pares eletrônicos da camada de valência (RPECV) da forma molecular é uma extensão das ideias de Lewis e é eficiente para estabelecer as formas de moléculas poliatômicas. Pelo modelo RPECV, regiões de densidades eletrônicas aumentadas admitem posições tão separadas quanto possível, de modo que as repulsões entre elas são minimizadas. Assinale a alternativa que apresenta o arranjo básico correto de regiões de densidade eletrônica, de acordo com o modelo RPECV.
- A.
Um par de elétrons - arranjo linear.
- B.
Dois pares de elétrons - arranjo trigonal planar.
- C.
Quatro pares de elétrons - arranjo tetraédrico.
- D.
Cinco pares de elétrons - arranjo octaédrico.
- E.
Seis pares de elétrons - arranjo trigonal piramidal.
A formação de ligações químicas com diferentes arranjos resulta na possibilidade de formação de milhares de compostos diferentes. Dessa forma, as ligações químicas são fundamentais para a química e para o entendimento das reações químicas. Assinale a alternativa que apresenta correlação adequada entre a interação apontada e a respectiva ligação química preponderante.
- A.
Interação entre átomos de mercúrio (Hg) no estado líquido → ligação iônica.
- B.
Interação entre moléculas de água (H2O) no estado líquido → ligação iônica.
- C.
Interação entre átomos de carbono (C) na forma de grafite → ligação covalente.
- D.
Interação entre íons sódio (Na+) e cloreto (Cl-) no estado sólido → ligação covalente.
- E.
Interação entre moléculas de hidrogênio (H2) no estado gasoso → ligação de hidrogênio.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação Universa (FUNIVERSA) - 2010
Muitas propriedades químicas podem ser explicadas em termos das propriedades dos átomos, sendo esse o ponto central no desenvolvimento e no entendimento da química. Os cientistas, por sua vez, constroem modelos que expliquem a estrutura do átomo com base em suas propriedades. Entre os modelos atômicos, tem-se o de Rutherford, posteriormente aperfeiçoado por Bohr, que basicamente apresenta um modelo
- A.
de átomo caracterizado como uma partícula maciça indivisível e eletricamente neutra.
- B.
de átomo com base na medição da densidade eletrônica em torno de um núcleo positivo.
- C.
no qual o átomo é uma esfera de carga positiva com a presença de elétrons nela suspensa.
- D.
no qual o átomo apresenta o princípio da incerteza e o comportamento de dualidade onda-partícula.
- E.
de átomo no qual há uma densa carga positiva central circundada por um grande volume de espaço vazio.
Texto VII, para responder às questões 34 e 35. Uma explosão em uma plataforma petrolífera transformou as águas do mar do Golfo do México, nos Estados Unidos da América, no cenário de uma tragédia ambiental. Milhares de toneladas de petróleo despejadas ameaçam a existência de mais de 600 espécies de seres vivos. As consequências para a vida na região demorarão décadas para serem superadas.´
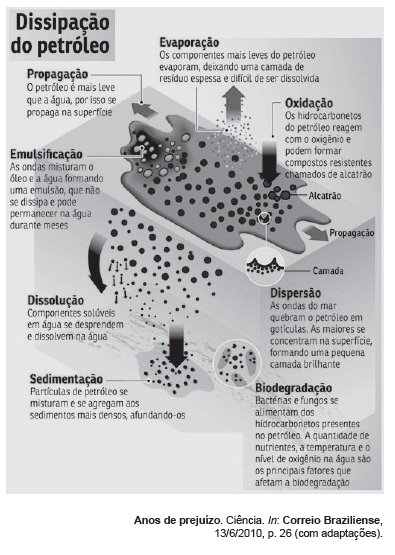
O conhecimento acerca das etapas de dissipação do petróleo derramado no mar é essencial para a amenização da tragédia ambiental. Entre as etapas de dissipação apresentadas no texto VII, aquelas em que efetivamente ocorrem reações químicas são
- A.
dissolução e oxidação.
- B.
dispersão e propagação.
- C.
oxidação e biodegradação.
- D.
evaporação e emulsificação.
- E.
emulsificação e biodegradação.
Texto VII, para responder às questões 34 e 35. Uma explosão em uma plataforma petrolífera transformou as águas do mar do Golfo do México, nos Estados Unidos da América, no cenário de uma tragédia ambiental. Milhares de toneladas de petróleo despejadas ameaçam a existência de mais de 600 espécies de seres vivos. As consequências para a vida na região demorarão décadas para serem superadas.´
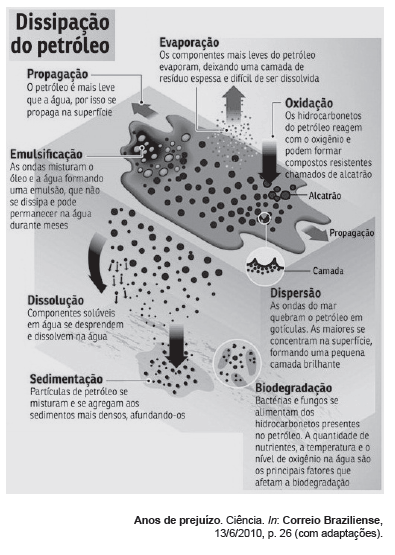
Para o entendimento e a resolução do impacto ambiental citado no texto VII, é necessário o conhecimento dos componentes essenciais do petróleo. Sabe-se, contudo, que o petróleo não é uma substância pura, mas uma mistura de diversas substâncias. Assim sendo, a composição química do petróleo é expressa
- A.
a partir dos compostos que continuamente estão presentes.
- B.
com base nos elementos obtidos por meio de sua análise química.
- C.
partindo-se dos compostos representativos de suas características orgânicas.
- D.
a partir dos compostos que são obtidos por meio de sua destilação/fracionamento.
- E.
pela sua natureza constante, que independe de sua origem ou localização geográfica.
O ácido oxálico (etanodioico) é usado em lavanderias comerciais e na remoção de ferrugem e de depósitos em radiadores de automóveis. Esses usos são consequência da capacidade do ácido oxálico de formar complexos solúveis com os íons ferro. Essa propriedade também o torna bastante venenoso. O nome deriva do grego oxalis, que significa ácido, e do gênero de algumas plantas herbáceas. Os cálculos renais, por exemplo, são formados por depósitos de oxalato de cálcio, na forma de pequenos cristais que não se dissolvem. As figuras seguintes representam, respectivamente, as fórmulas da molécula de ácido oxálico e do composto oxalato de cálcio.
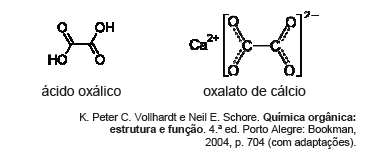
Avaliando as afinidades químicas dos compostos apresentados no texto VI, é possível delinear relações quantitativas envolvidas em determinadas reações. Entre essas reações, está a de formação de oxalato de cálcio, a partir de ácido oxálico e hidróxido de cálcio. Considerando uma amostra de 150 mL de solução de ácido oxálico na concentração de 0,05 mol L1, o volume de solução de hidróxido de cálcio a 0,2 mol L1 necessário para converter todo o ácido oxálico dessa amostra em oxalato de cálcio é igual a
- A.
7,5 mL.
- B.
37,5 mL.
- C.
75,0 mL.
- D.
150,0 mL.
- E.
600,0 mL.
O ácido oxálico (etanodioico) é usado em lavanderias comerciais e na remoção de ferrugem e de depósitos em radiadores de automóveis. Esses usos são consequência da capacidade do ácido oxálico de formar complexos solúveis com os íons ferro. Essa propriedade também o torna bastante venenoso. O nome deriva do grego oxalis, que significa ácido, e do gênero de algumas plantas herbáceas. Os cálculos renais, por exemplo, são formados por depósitos de oxalato de cálcio, na forma de pequenos cristais que não se dissolvem. As figuras seguintes representam, respectivamente, as fórmulas da molécula de ácido oxálico e do composto oxalato de cálcio.
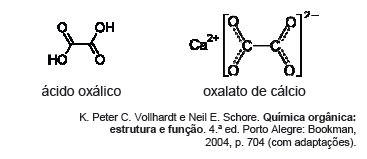
Conforme o texto VI, o composto oxalato de cálcio é conhecido por sua baixa solubilidade em água, que pode resultar em cálculos renais. Com relação à sua classificação química, esse composto é considerado um(a)
- A.
sal orgânico.
- B.
base orgânica.
- C.
óxido orgânico.
- D.
ácido orgânico.
- E.
hidreto orgânico.


