Questões de Química da Universidade Federal do Rio de Janeiro (UFRJ)
Lista completa de Questões de Química da Universidade Federal do Rio de Janeiro (UFRJ) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Universidade Federal do Rio de Janeiro (UFRJ) - 2012
O pH da solução resultante da mistura de volumes iguais das soluções de ácido fosfórico (pka1 = 2,14; pKa2 = 7,20 e pKa3 = 12,1) 0,2 moL/L e de hidróxido de sódio 0,1 moL/L, considerando que a reação é completa, é igual a
- A. 2,14.
- B. 7,00.
- C. 7,20.
- D. 12,1.
- E. 13,0.
A dicromatometria é uma técnica amplamente empregada nos laboratórios de ensino e pesquisa para determinar do teor de ferro em minérios através de uma reação de oxirredução entre os íons ferro e os íons dicromato. Nessa determinação, utiliza-se como titulante uma solução de dicromato de potássio e, junto com o titulado, usa-se cloreto estanoso, difenilamina, ácido fosfórico e cloreto de mercúrio (II). A seguir, são feitas algumas afirmações acerca dessa técnica. Assinale a alternativa correta.
- A. Nesta técnica se faz necessário o uso de um indicador redox que é a difenilamina.
- B. O cloreto estanoso tem a função de oxidar os íons Fe+2 a Fe+3, para que a reação aconteça.
- C. C) O cloreto de mercúrio (II) tem a função de reduzir o potencial do sistema Fe+2/Fe+3.
- D. Nesta reação são trocados três elétrons entre os íons ferro e os íons dicromato.
- E. No ponto final desta titulação os íons Cr+3, conferem à solução uma coloração azul.
Química - Reações, Soluções e Transformações Químicas - Universidade Federal do Rio de Janeiro (UFRJ) - 2012
Considerando que todas as reações envolvidas nas misturas abaixo se deslocam completamente na direção de formação dos produtos, qual mistura pode ser classificada como solução tampão?
- A. 25 mL de solução de ácido acético (pka=4,76) 0,2 moL/L com 0,2 g de hidróxido de sódio.
- B. 25 mL de solução de ácido clorídrico 0,2 moL/L com 16 mL de solução de hidróxido de sódio 0,5 moL/L.
- C. 30 mL de solução de cloreto de amônio (pka=9,24) 0,2 moL/L com 15 mL de solução de hidróxido de sódio 0,2 moL/L.
- D. 30 mL de solução de ácido lático (pka=3,85) 0,1 moL/L com 15 mL de solução de hidróxido de sódio 0,2 moL/L
- E. 50 mL de ácido clorídrico 0,1 moL/L com 30 mL de hidróxido de cálcio 0,2 moL/L.
Química - Reações, Soluções e Transformações Químicas - Universidade Federal do Rio de Janeiro (UFRJ) - 2012
Suponha um ácido fraco HA (101 g/mol) cujo sal da sua base conjugada, NaA, seja utilizado contra a acidez estomacal, na forma de pastilhas, contendo cada uma delas 0,025 g de NaA. Considerando que um indivíduo tenha, em seu estômago, 1 mL de suco gástrico com pH 1 e que ele tenha ingerido 2 pastilhas, a porcentagem aproximada de HA produzida neste processo será de
- A. 2,5%.
- B. 20%.
- C. 25%.
- D. 40%.
- E. 50%.
Um laboratório de ensino tem como uma de suas normas de segurança descartar na pia somente soluções neutras. Ao término de uma aula prática, o técnico observou que, em cada uma das doze bancadas, restou um béquer contendo 40 mL de Ca(OH)2 0,2 mol/L. O volume de solução de HNO3 0,3 moL/L a ser usado para neutralizar todo o resíduo desta aula é
- A. 26,7 mL.
- B. 53,3 mL.
- C. 320 mL.
- D. 640 mL.
- E. 960 mL.
Em relação à espectroscopia molecular no ultravioleta-visível é correto, afirmar que
- A. a técnica fornece informações a respeito da estrutura molecular de substâncias com ligações simples.
- B. para a análise de substâncias por espectroscopia na região do ultravioleta, deve-se usar cubeta de vidro.
- C. a lâmpada de tungstênio é a mais usada para emissão de radiação na região do ultravioleta.
- D. de acordo com a lei de Beer, a absorvância é inversamente proporcional à concentração da espécie absorvente.
- E. o processo de absorção na região do ultravioleta envolve transição dos elétrons de valência da molécula.
A cromatografia em fase gasosa (CG) é uma técnica analítica que permite separar e quantificar componentes voláteis de uma mistura. Acerca deste tipo de cromatografia, é correto afirmar que
- A. a fase estacionária pode ser líquida ou sólida, enquanto a fase móvel pode ser líquida ou gás.
- B. a temperatura da coluna é elevada durante a separação para aumentar a capacidade de retenção da fase estacionária.
- C. as colunas capilares apresentam grande diâmetro interno e por isso tem baixa resolução, quando comparada às colunas empacotadas.
- D. a análise quantitativa está baseada no tempo de retenção e na velocidade com que cada componente da mistura atravessa a coluna.
- E. a estabilidade térmica e a volatilidade são pré-requisitos para que as amostras sejam analisadas por CG.
Sobre a cromatografia em camada delgada (CCD) como técnica de separação para os componentes de uma mistura, é correto afirmar que
- A. a CCD pode ser classificada como cromatografia em coluna aberta em relação a sua forma física.
- B. a fase estacionária, na cromatografia de fase normal, é não polar e usa-se um solvente polar.
- C. o parâmetro qualitativo mais importante a ser considerado, na análise por CCD, é o fator de retenção (Rf).
- D. as fases móveis mais utilizadas, na análise por CCD, para a separação de misturas, são celulose e alumina.
- E. a CCD é um método de extração onde a amostra não pode interagir com as duas fases (móvel e estacionária).
- Assinale a alternativa correta que relaciona a aparelhagem, vidraria ou materiais utilizados no laboratório com sua aplicação.
- A. O polarímetro é um instrumento usado para determinação do ponto de fusão de uma amostra.
- B. O almofariz com pistilo, de porcelana ou vidro, é utilizado para pulverizar e triturar sólidos.
- C. As estufas são fornos elétricos utilizados para calcinar amostras em altas temperaturas.
- D. O funil de adição com equalizador de pressão é utilizado para filtração de amostras sólidas.
- E. O extrator Soxhlet é um frasco de porcelana utilizado para extração de líquidos miscíveis.
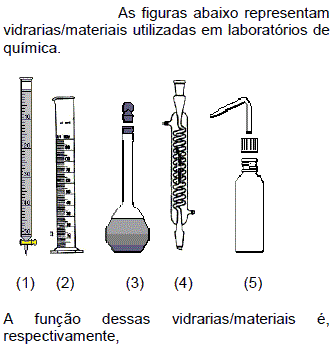
- A. 1 - estocar substâncias líquidas; 2 - medir e transferir volumes de líquidos; 3 - preparar soluções; 4 - titulação e análise volumétrica; 5 - lavagem de materiais.
- B. 1 - titulação e análise volumétrica; 2 - estocar substâncias líquidas; 3 - lavagem de materiais; 4 - condensar vapores; 5 - determinar densidade de líquidos.
- C. 1- determinar densidade de líquidos; 2 - preparar soluções; 3 - estocar substâncias líquidas; 4 - medir e transferir volumes de líquidos; 5 - lavagem de materiais.
- D. 1 - titulação e análise volumétrica; 2 - medir e transferir volumes de líquidos; 3 - preparar soluções; 4- condensar vapores; 5 - lavagem de materiais.
- E. 1 - titulação e análise volumétrica; 2 - preparar soluções; 3 - estocar substâncias líquidas; 4 - medir e transferir volumes de líquidos; 5 - lavagem de materiais.


