Questões de Engenharia Química
Lista completa de Questões de Engenharia Química para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
O aumento de 20% para 25% do teor de etanol na gasolina, sem modificação, num motor a gasolina, causa
- A.
aumento do desempenho termodinâmico.
- B.
aumento do consumo.
- C.
aumento do poder calorífico da mistura.
- D.
redução do consumo.
- E.
redução da octanagem.
Um dos mais sérios acidentes acontecidos numa refinaria brasileira causou explosões e várias mortes. Um operador abriu em seqüência uma série de válvulas em esferas de GLP para drenar a água depositada no fundo das esferas. A água era drenada para uma vala aberta.Quando o operador retornou para a primeira esfera, não conseguiu fechar a válvula, que já vazava GLP. O colchão de GLP formado explodiu ao encontrar a primeira fagulha. Qual o motivo da impossibilidade de fechar a válvula?
- A.
Havia certamente pouca ou nenhuma água na primeira esfera.
- B.
Gases se resfriam quando expandidos, o que, no caso, congelou a água, travando a válvula.
- C.
Gases se aquecem quando expandidos, o que dilatou a válvula, travando-a.
- D.
A expansão isentrópica congelou a água que imobilizou a válvula.
- E.
A expansão isentálpica aqueceu a válvula, dilatando-a e causando o travamento.
Compressores alternativos são mais indicados que compressores centrífugos nas situações de
- A.
altas pressões e temperaturas.
- B.
elevadas variações de pressão (entre descarga e sucção) e altas vazões.
- C.
elevadas variações de pressão e baixas vazões.
- D.
baixas variações de pressão e altas vazões.
- E.
baixas variações de pressão e baixas vazões.
Em trocadores de calor, os coeficientes de troca térmica aumentam na seguinte ordem:
- A.
líquido, líquido condensante, gás.
- B.
líquido, gás, líquido condensante.
- C.
líquido condensante, gás, líquido.
- D.
líquido condensante, líquido, gás.
- E.
gás, líquido, líquido condensante.
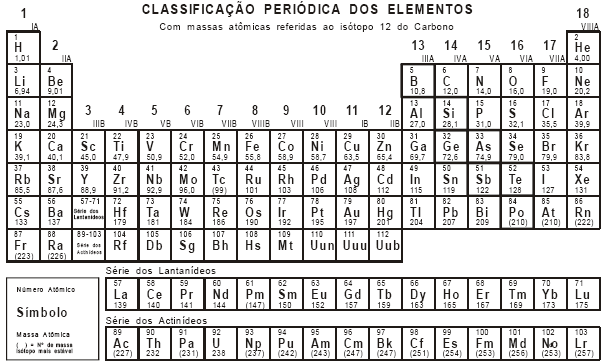
Com base nas entalpias padrão (ΔH°) para as reações abaixo, determine a entalpia padrão para a reação de formação do etano a partir do carbono sólido e do gás hidrogênio.

- A.
+276,9 kJ/mol
- B.
+776,7 kJ/mol
- C.
−276,9 kJ/mol
- D.
−83,7 kJ/mol
- E.
−3776,7 kJ/mol
Os alcanos halogenados C3H7Br, C3H7Cl, C3H7I, CH3Cl, C2H5Cl, em ordem crescente de ponto de ebulição são:
- A.
clorometano, cloroetano, 1-cloropropano, 1-bromopropano, 1-iodopropano.
- B.
clorometano, cloroetano, 1-cloropropano, 1-iodopropano, 1-bromopropano.
- C.
1-bromopropano, 1-iodopropano, 1-cloropropano, cloroetano, clorometano.
- D.
2-cloropropano, 2-bromobutano, 2-iodobutano, cloroetano, clorometano.
- E.
clorometano, cloroetano, 1-iodopropano, 1-bromopropano, 1-cloropropano.
A diferença de potencial obtida na pilha, representada pela figura abaixo, no início de sua operação é
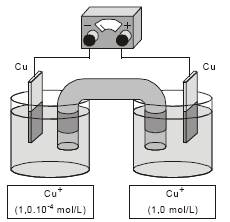
- A.
0,06 V.
- B.
1,6 V.
- C.
2,36 V.
- D.
12 V.
- E.
115 V.
Em um experimento colocou-se SO2Cl2(g) em um recipiente lacrado, mantido a 400 K. Nesta temperatura, a constante de equilíbrio Kp para a reação de decomposição deste gás: SO2Cl2(g) ↔ SO2(g) + Cl2(g) é 2,4 quando as pressões são medidas em atmosferas (atm). Determine a pressão parcial do gás cloro formado no equilíbrio a 400 K, se, neste experimento, a pressão do equilíbrio medida foi 3 atm.
- A.
0,94 atm
- B.
1,05 atm
- C.
1,52 atm
- D.
2,11 atm
- E.
0,67 atm
Calcule a vazão volumétrica de ar (em L/min a 300 K e 1 atm) necessária para obter-se a combustão completa de uma mistura com vazão molar de 10 mol/min com 40% (mol/mol) de etano e 60% (mol/mol) de propano. Considere que o ar é uma mistura de gases ideais contendo 20% de oxigênio em porcentagem molar.
Dados:
R
= 0,082 atm.L/(molK)- A.
714 L/min.
- B.
1046 L/min.
- C.
4836 L/min.
- D.
5043 L/min.
- E.
5412 L/min.
Em um experimento para determinar a taxa de reação da hidrólise do acetato de etila em meio básico, foram misturados 500 mL de uma solução 0,2 mol/L de NaOH e 500 mL de uma solução 0,2 mol/L de acetato de etila. Após 5 min foi retirada uma alíquota de 50 mL do meio reacional e misturada com 50 mL de uma solução 0,1 mol/L de ácido clorídrico. Esta mistura foi titulada com uma solução de NaOH 0,1 mol/L e foram gastos 25 mL para neutralizá-la. Sabendo que a reação da hidrólise do acetato com NaOH ocorre na proporção molar de 1:1, determine a concentração de acetato de etila do meio reacional após 5 min.
- A.
0,025 mol/L
- B.
0,050 mol/L
- C.
0,075 mol/L
- D.
0,100 mol/L
- E.
0,125 mol/L


