Questões de Engenharia Química
Lista completa de Questões de Engenharia Química para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
O Ferro metálico (Fe0) pode ser obtido a partir da redução de um óxido de ferro, como a hematita (Fe2O3), utilizando um agente redutor como o monóxido de carbono. Se 80 toneladas de uma amostra de minério de ferro com 80% de pureza (em termos de massa de hematita por massa total) forem processadas para a obtenção de ferro metálico, quantas toneladas de CO2 serão lançadas na atmosfera?
Dados:
M
Fe = 56 g/gmol- A.
52,8 ton.
- B.
66,0 ton.
- C.
35,2 ton.
- D.
44,0 ton.
- E.
48,0 ton.
Um grupo de contaminantes muito perigoso para a saúde do ser humano é o das dioxinas. Considerando que a quantidade máxima tolerável de dioxinas presente nas gorduras encontradas em queijos são 3 ppt e que, em média, um quilo de queijo possui entre 180 g e 400 g de gorduras, determine quais das amostras de queijo, apresentadas abaixo, são impróprias para consumo humano.
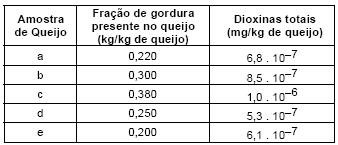
- A.
São impróprias as amostras b e e.
- B.
São impróprias as amostras a, b e c.
- C.
Apenas a amostra c é imprópria.
- D.
Todas as amostras são impróprias.
- E.
São impróprias as amostras a e e.
Em um processo industrial de descafeinação de café utilizando dióxido de carbono supercrítico, a área superficial das partículas de café moído é muito importante. Quanto maior esta área, menor a resistência à transferência de massa. Considerando que neste processo industrial normalmente utilizam-se partículas esféricas de café moído com 4 mm de diâmetro, o acréscimo na área superficial (em m2/kg de partículas) ao se utilizar partículas com diâmetros 50% menores será de:
Dados:
ρpartículas = 1200 kg/m3
- A.
0,67 m2/kg.
- B.
1,00 m2/kg.
- C.
1,25 m2/kg.
- D.
2,00 m2/kg.
- E.
2,50 m2/kg.
Considere as afirmativas abaixo sobre sabões e detergentes, compostos orgânicos utilizados em larga escala para remoção de gorduras.
I. Tanto as moléculas de sabão como as de detergente reagem com as gorduras quebrando a cadeia carbônica destes compostos e, desta forma, aumentando sua solubilidade em água.
II. A diferença entre detergentes sulfonados biodegradáveis e não-biodegradáveis são as estruturas das cadeias laterais, enquanto que no detergente biodegradável esta cadeia é linear, no detergente não biodegradável esta cadeia é ramificada.
III. Tanto as moléculas dos detergentes como as dos de sabões possuem uma parte hidrofílica e uma parte hidrofóbica.
IV. Na reação para a obtenção de sabão comum, os glicerídeos (gorduras de fonte animal) reagem com soda cáustica produzindo glicerol mais o sabão propriamente dito.
V. As moléculas de sabões e detergentes formam micelas com superfícies hidrofóbicas.
É correto o que se afirma APENAS em
- A.
II, III, e IV.
- B.
I, II e V.
- C.
III e V.
- D.
II, IV e V.
- E.
I, II e III e IV.
A figura abaixo descreve um sistema do tipo cilindropistão. Considere que não existe atrito entre o pistão e a parede do cilindro. Inicialmente a pressão no interior do cilindro é de 2 . 105 Pa e a temperatura é 300 K. Calcule o trabalho necessário, por mol de gás no interior do cilindro, para que o sistema atinja a nova condição de equilíbrio após a retirada do pino "A". Considere também que o processo é isotérmico e que a pressão externa é a atmosférica (1 . 105 Pa).
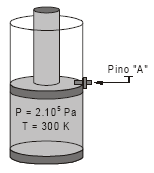
- A.
−2494,2 J/mol
- B.
−1728,8 J/mol
- C.
−1247,1 J/mol
- D.
1728,8 J/mol
- E.
2494,2 J/mol
Uma turbina é alimentada com vapor superaquecido a 600 °C e 8 atm. A corrente de alimentação tem uma velocidade de 80 m/s e vazão mássica de 4,0 kg/s. A corrente de saída tem velocidade de 20 m/s, temperatura de 300 °C e pressão 1 atm. Se o equipamento opera em regime de estado estacionário, qual a máxima quantidade de trabalho possível de se extrair desta turbina?
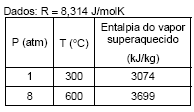
- A.
2500,0 kJ/s.
- B.
2512,0 kJ/s.
- C.
2506,0 kJ/s.
- D.
2514,4 kJ/s.
- E.
2524,0 kJ/s.
Determine a pressão de bolha (Pbolha) de uma mistura líquida contendo 20% de pentano, 50% hexano e 30% de heptano (em composição molar) e a fração molar de pentano (yp) na fase vapor em equilíbrio com esta mistura líquida mantida a 60 °C. Nesta temperatura, as pressões de vapor do pentano, hexano e heptano são, respectivamente, 2,9; 1,1 e 0,4 bar.
- A.
Pbolha = 1,25; yp = 0,464.
- B.
Pbolha = 1,79; yp = 0,810.
- C.
Pbolha = 1,79; yp = 0,780.
- D.
Pbolha = 1,25; yp = 0,522.
- E.
Pbolha = 1,79; yp = 0,580.
Considere as afirmativas e a figura abaixo, que representa o diagrama de fases para uma substância pura.
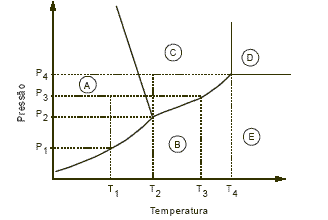
I. As regiões A, D e E representam regiões em que a substância seria um sólido, um fluido-supercrítico e um gás, respectivamente.
II. A temperatura e a pressão do ponto triplo desta substância são T4 e P4.
III. Se esta substância estiver inicialmente na temperatura e na pressão T1 e P3, ao elevar-se a temperatura até T2, mantendo a pressão constante, mudase o estado de agregação da substância de sólido para líquido.
IV. A pressão P1 é a pressão de liquefação na temperatura T1, para esta substância.
V. A temperatura T3 é a temperatura de ebulição desta substância na pressão P3.
É correto o que se afirma APENAS em
- A.
III, IV e V.
- B.
II, III e V.
- C.
I, II e IV.
- D.
I, III e V.
- E.
II e V.
Um grupo de pesquisadores mediu a variação da pressão de vapor do Argônio com a temperatura na vizinhança de 84 K e determinou a seguinte correlação: T B lnPvap = A − B/T ; sendo A = 22,5 e B = 995,2 K. Determine a variação de entropia na mudança de fase (líquido-vapor) do argônio a 84 K.
Dados:
(R = 8,314 J/molK)
- A.
2,2 J/molK.
- B.
31,0 J/molK.
- C.
98,5 J/molK.
- D.
15,7.102 J.K/mol.
- E.
69,5.104 J.K/mol.
A Equação de Estado de van der Waals, 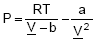 foi a primeira a predizer com relativo sucesso o equilíbrio transição líquido–vapor de substâncias puras. Sabendo que os coeficientes "a" e "b" são específicos para cada substância e não são dependentes nem da temperatura nem da pressão.
foi a primeira a predizer com relativo sucesso o equilíbrio transição líquido–vapor de substâncias puras. Sabendo que os coeficientes "a" e "b" são específicos para cada substância e não são dependentes nem da temperatura nem da pressão.
I. O coeficiente "b" da equação para uma dada substância, representa o menor volume possível que um mol desta substância pode assumir.
II. Em baixas temperaturas e altas pressões o resultado obtido através da equação de van der Waals para o volume molar tende a ser muito próximo do resultado obtido (para o volume molar) utilizando-se a equação dos gases ideais.
III. O termo (− a/V2) é o termo que leva em consideração as forças de atração entre as moléculas das substâncias puras.
IV. Esta é uma equação cúbica em V, em temperaturas abaixo da crítica, para uma mesma pressão de vapor a dada temperatura tem-se três raízes, a menor é o volume molar do líquido, a maior é o volume molar do vapor e a intermediária não tem sentido físico.
V. Para volumes molares muito grandes os resultado apresentados por esta equação tendem aos resultado obtidos pela equação dos gases ideais, em uma mesma temperatura.
É correto o que se afirma APENAS em
- A.
II e V.
- B.
I, IV, e V.
- C.
II, III, e V.
- D.
I, II, III, e IV.
- E.
I, III, IV e V.


