Questões de Engenharia Química do ano 2007
Lista completa de Questões de Engenharia Química do ano 2007 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Com base nas entalpias padrão (ΔH°) para as reações abaixo, determine a entalpia padrão para a reação de formação do etano a partir do carbono sólido e do gás hidrogênio.

- A.
+276,9 kJ/mol
- B.
+776,7 kJ/mol
- C.
−276,9 kJ/mol
- D.
−83,7 kJ/mol
- E.
−3776,7 kJ/mol
Os alcanos halogenados C3H7Br, C3H7Cl, C3H7I, CH3Cl, C2H5Cl, em ordem crescente de ponto de ebulição são:
- A.
clorometano, cloroetano, 1-cloropropano, 1-bromopropano, 1-iodopropano.
- B.
clorometano, cloroetano, 1-cloropropano, 1-iodopropano, 1-bromopropano.
- C.
1-bromopropano, 1-iodopropano, 1-cloropropano, cloroetano, clorometano.
- D.
2-cloropropano, 2-bromobutano, 2-iodobutano, cloroetano, clorometano.
- E.
clorometano, cloroetano, 1-iodopropano, 1-bromopropano, 1-cloropropano.
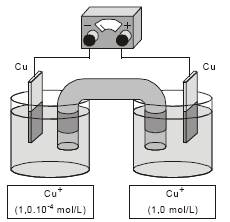
A diferença de potencial obtida na pilha, representada pela figura abaixo, no início de sua operação é
- A.
0,06 V.
- B.
1,6 V.
- C.
2,36 V.
- D.
12 V.
- E.
115 V.
Em um experimento colocou-se SO2Cl2(g) em um recipiente lacrado, mantido a 400 K. Nesta temperatura, a constante de equilíbrio Kp para a reação de decomposição deste gás: SO2Cl2(g) ↔ SO2(g) + Cl2(g) é 2,4 quando as pressões são medidas em atmosferas (atm). Determine a pressão parcial do gás cloro formado no equilíbrio a 400 K, se, neste experimento, a pressão do equilíbrio medida foi 3 atm.
- A.
0,94 atm
- B.
1,05 atm
- C.
1,52 atm
- D.
2,11 atm
- E.
0,67 atm
Calcule a vazão volumétrica de ar (em L/min a 300 K e 1 atm) necessária para obter-se a combustão completa de uma mistura com vazão molar de 10 mol/min com 40% (mol/mol) de etano e 60% (mol/mol) de propano. Considere que o ar é uma mistura de gases ideais contendo 20% de oxigênio em porcentagem molar.
Dados:
R
= 0,082 atm.L/(molK)- A.
714 L/min.
- B.
1046 L/min.
- C.
4836 L/min.
- D.
5043 L/min.
- E.
5412 L/min.
Em um experimento para determinar a taxa de reação da hidrólise do acetato de etila em meio básico, foram misturados 500 mL de uma solução 0,2 mol/L de NaOH e 500 mL de uma solução 0,2 mol/L de acetato de etila. Após 5 min foi retirada uma alíquota de 50 mL do meio reacional e misturada com 50 mL de uma solução 0,1 mol/L de ácido clorídrico. Esta mistura foi titulada com uma solução de NaOH 0,1 mol/L e foram gastos 25 mL para neutralizá-la. Sabendo que a reação da hidrólise do acetato com NaOH ocorre na proporção molar de 1:1, determine a concentração de acetato de etila do meio reacional após 5 min.
- A.
0,025 mol/L
- B.
0,050 mol/L
- C.
0,075 mol/L
- D.
0,100 mol/L
- E.
0,125 mol/L
O Ferro metálico (Fe0) pode ser obtido a partir da redução de um óxido de ferro, como a hematita (Fe2O3), utilizando um agente redutor como o monóxido de carbono. Se 80 toneladas de uma amostra de minério de ferro com 80% de pureza (em termos de massa de hematita por massa total) forem processadas para a obtenção de ferro metálico, quantas toneladas de CO2 serão lançadas na atmosfera?
Dados:
M
Fe = 56 g/gmol- A.
52,8 ton.
- B.
66,0 ton.
- C.
35,2 ton.
- D.
44,0 ton.
- E.
48,0 ton.
Um grupo de contaminantes muito perigoso para a saúde do ser humano é o das dioxinas. Considerando que a quantidade máxima tolerável de dioxinas presente nas gorduras encontradas em queijos são 3 ppt e que, em média, um quilo de queijo possui entre 180 g e 400 g de gorduras, determine quais das amostras de queijo, apresentadas abaixo, são impróprias para consumo humano.
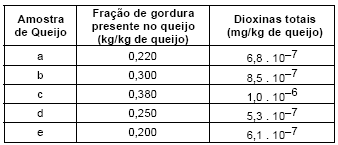
- A.
São impróprias as amostras b e e.
- B.
São impróprias as amostras a, b e c.
- C.
Apenas a amostra c é imprópria.
- D.
Todas as amostras são impróprias.
- E.
São impróprias as amostras a e e.
Em um processo industrial de descafeinação de café utilizando dióxido de carbono supercrítico, a área superficial das partículas de café moído é muito importante. Quanto maior esta área, menor a resistência à transferência de massa. Considerando que neste processo industrial normalmente utilizam-se partículas esféricas de café moído com 4 mm de diâmetro, o acréscimo na área superficial (em m2/kg de partículas) ao se utilizar partículas com diâmetros 50% menores será de:
Dados:
ρpartículas = 1200 kg/m3
- A.
0,67 m2/kg.
- B.
1,00 m2/kg.
- C.
1,25 m2/kg.
- D.
2,00 m2/kg.
- E.
2,50 m2/kg.
Considere as afirmativas abaixo sobre sabões e detergentes, compostos orgânicos utilizados em larga escala para remoção de gorduras.
I. Tanto as moléculas de sabão como as de detergente reagem com as gorduras quebrando a cadeia carbônica destes compostos e, desta forma, aumentando sua solubilidade em água.
II. A diferença entre detergentes sulfonados biodegradáveis e não-biodegradáveis são as estruturas das cadeias laterais, enquanto que no detergente biodegradável esta cadeia é linear, no detergente não biodegradável esta cadeia é ramificada.
III. Tanto as moléculas dos detergentes como as dos de sabões possuem uma parte hidrofílica e uma parte hidrofóbica.
IV. Na reação para a obtenção de sabão comum, os glicerídeos (gorduras de fonte animal) reagem com soda cáustica produzindo glicerol mais o sabão propriamente dito.
V. As moléculas de sabões e detergentes formam micelas com superfícies hidrofóbicas.
É correto o que se afirma APENAS em
- A.
II, III, e IV.
- B.
I, II e V.
- C.
III e V.
- D.
II, IV e V.
- E.
I, II e III e IV.


