Questões de Engenharia Química do ano 2010
Lista completa de Questões de Engenharia Química do ano 2010 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.

- A.

- B.

- C.

- D.

- E.

A curva característica de uma bomba centrífuga é Q2 + 2 H2 = 3 em que Q é vazão volumétrica de líquido em metros cúbicos por segundo e H é a carga correspondente em metros de coluna de líquido. Se a curva de um sistema de tubos, conexões e outros acessórios, para o mesmo líquido, é H = (2)1/2Q2 e, se a bomba vier a ser usada no referido sistema, a vazão volumétrica com que ela irá operar, em m3 /s, é
- A. 1/2
- B. (2)1/2/2
- C. 1/3
- D. (3)1/2/3
- E. (3)1/2/2
Uma bomba centrífuga com curva característica do tipo Q2 = y w H2, em que Q é vazão volumétrica, H é carga expressa em altura de coluna de líquido, sendo y e w constantes dimensionais, é usada na transferência de um solvente entre dois tanques. A tubulação a jusante da bomba tem diâmetro D e, devido a problemas de corrosão, será substituída por outra de diâmetro 0,8 D. Em decorrência dessa modificação, a carga positiva de sucção (CPS), disponível na instalação de bombeamento,
- A. não vai se alterar.
- B. diminuirá de 20%.
- C. diminuirá de 40%.
- D. diminuirá de 64%.
- E. aumentará.

- A.

- B.

- C.

- D.

- E.

Um fluido escoa com vazão constante, de cima para baixo, da seção transversal A para a seção transversal B de uma tubulação vertical de diâmetro uniforme. Supondo-se que o fluido é ideal/invíscido e incompressível, entre A e B ocorre, no fluido, conversão de carga de
- A. velocidade em carga de altura.
- B. velocidade em carga de pressão.
- C. altura em carga de pressão.
- D. altura em carga de velocidade.
- E. pressão em carga de velocidade.
Um tanque é completamente preenchido com 16,0 kg de metano puro (CH4), componente majoritário do gás natural. A equação a seguir apresenta a reação de combustão do metano, cuja entalpia-padrão, a 25 ºC, é igual a !890 kJ/mol.
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (R)
Com base na informações acima e considerando que a massa molar do metano seja 16,0 g/mol, que a constante universal dos gases valha 0,08 atm.L.mol-1 K-1 e que os gases envolvidos na reação se comportem de forma ideal, julgue os itens que se seguem.
A massa de metano que deve ser queimada, a 25 ºC e 1,0 bar, para gerar 44.500 kJ de calor é maior que 500 g.
- C. Certo
- E. Errado
Um tanque é completamente preenchido com 16,0 kg de metano puro (CH4), componente majoritário do gás natural. A equação a seguir apresenta a reação de combustão do metano, cuja entalpia-padrão, a 25 ºC, é igual a !890 kJ/mol.
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (R)
Com base na informações acima e considerando que a massa molar do metano seja 16,0 g/mol, que a constante universal dos gases valha 0,08 atm.L.mol-1 K-1 e que os gases envolvidos na reação se comportem de forma ideal, julgue os itens que se seguem.
Considerando que a uma temperatura de 270 K o metano tenha atingido uma pressão de 200 atm e que nessas condições o fator de compressibilidade do gás tenha sido igual a 0,80, é correto inferir que o tanque em questão possui volume maior que 100 L.
- C. Certo
- E. Errado
Um tanque é completamente preenchido com 16,0 kg de metano puro (CH4), componente majoritário do gás natural. A equação a seguir apresenta a reação de combustão do metano, cuja entalpia-padrão, a 25 ºC, é igual a !890 kJ/mol.
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (R)
Com base na informações acima e considerando que a massa molar do metano seja 16,0 g/mol, que a constante universal dos gases valha 0,08 atm.L.mol-1 K-1 e que os gases envolvidos na reação se comportem de forma ideal, julgue os itens que se seguem.
O módulo do calor de combustão padrão do metano, a volume constante e a 25 ºC, é maior que 890 kJ/mol.
- C. Certo
- E. Errado
A figura seguinte ilustra, em um diagrama de pressão versus volume, a expansão isotérmica reversível de um mol de um gás ideal, desde um estado inicial A, correspondente a uma pressão de 300 kPa e um volume de 8,00 L, até um estado final B, com pressão e volume iguais a 100 kPa e 20,00 L, respectivamente.
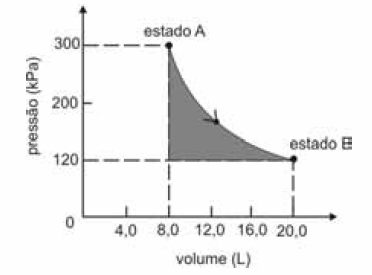
Com base nessas informações e considerando que a constante universal dos gases, R, seja igual a 8,3 .J.mol -1 K -1 e que os logaritmos naturais de 5 e 2 sejam iguais a 1,609 e 0,693, respectivamente, julgue os itens a seguir.
O calor, q, que entra para o sistema a partir das vizinhanças durante a transformação em questão é maior que o produto nRT, em que n e T representam, respectivamente, a quantidade de matéria e a temperatura do gás.
- C. Certo
- E. Errado
A figura seguinte ilustra, em um diagrama de pressão versus volume, a expansão isotérmica reversível de um mol de um gás ideal, desde um estado inicial A, correspondente a uma pressão de 300 kPa e um volume de 8,00 L, até um estado final B, com pressão e volume iguais a 100 kPa e 20,00 L, respectivamente.
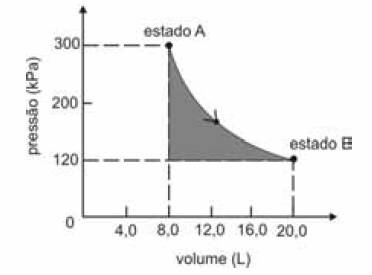
Com base nessas informações e considerando que a constante universal dos gases, R, seja igual a 8,3 .J.mol -1 K -1 e que os logaritmos naturais de 5 e 2 sejam iguais a 1,609 e 0,693, respectivamente, julgue os itens a seguir.
A variação de entropia durante a transformação descrita é maior que 5 J/K.
- C. Certo
- E. Errado


