Questões de Engenharia Química do ano 2010
Lista completa de Questões de Engenharia Química do ano 2010 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
A figura seguinte ilustra, em um diagrama de pressão versus volume, a expansão isotérmica reversível de um mol de um gás ideal, desde um estado inicial A, correspondente a uma pressão de 300 kPa e um volume de 8,00 L, até um estado final B, com pressão e volume iguais a 100 kPa e 20,00 L, respectivamente.
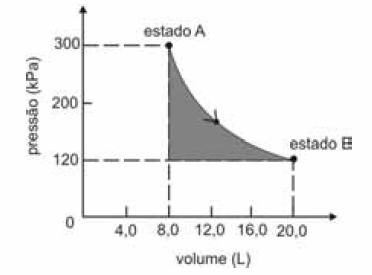
Com base nessas informações e considerando que a constante universal dos gases, R, seja igual a 8,3 .J.mol -1 K -1 e que os logaritmos naturais de 5 e 2 sejam iguais a 1,609 e 0,693, respectivamente, julgue os itens a seguir.
Considere que, após a referida transformação, o sistema tenha retornado ao estado A. Nessa situação, qualquer que seja o caminho de retorno, o calor trocado com as vizinhanças e o trabalho realizado pelo sistema durante o ciclo (estado A → estado B → estado A) são ambos iguais a zero, pois calor e trabalho são funções de estado termodinâmicas.
- C. Certo
- E. Errado
A figura seguinte ilustra, em um diagrama de pressão versus volume, a expansão isotérmica reversível de um mol de um gás ideal, desde um estado inicial A, correspondente a uma pressão de 300 kPa e um volume de 8,00 L, até um estado final B, com pressão e volume iguais a 100 kPa e 20,00 L, respectivamente.
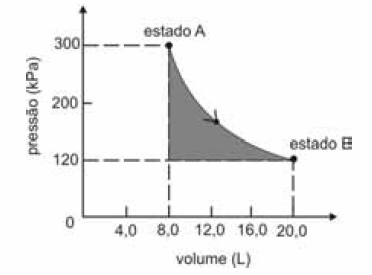
Com base nessas informações e considerando que a constante universal dos gases, R, seja igual a 8,3 .J.mol -1 K -1 e que os logaritmos naturais de 5 e 2 sejam iguais a 1,609 e 0,693, respectivamente, julgue os itens a seguir.
A temperatura do gás é maior que 300 K.
- C. Certo
- E. Errado
A figura seguinte ilustra, em um diagrama de pressão versus volume, a expansão isotérmica reversível de um mol de um gás ideal, desde um estado inicial A, correspondente a uma pressão de 300 kPa e um volume de 8,00 L, até um estado final B, com pressão e volume iguais a 100 kPa e 20,00 L, respectivamente.
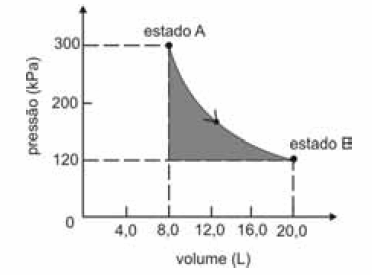
Com base nessas informações e considerando que a constante universal dos gases, R, seja igual a 8,3 .J.mol -1 K -1 e que os logaritmos naturais de 5 e 2 sejam iguais a 1,609 e 0,693, respectivamente, julgue os itens a seguir.
A área sombreada do gráfico corresponde ao trabalho realizado pelo gás durante a referida expansão.
- C. Certo
- E. Errado
Para a seguinte reação, a constante de equilíbrio a uma temperatura T é igual a 400.
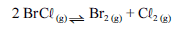
Com base nessa informação e considerando que os logaritmos naturais de 5 e 2 sejam iguais a 1,609 e 0,693, respectivamente, julgue os itens seguintes.
Para a reação em questão, o volume da câmara não influencia a velocidade com que o equilíbrio é atingido.
- C. Certo
- E. Errado
Para a seguinte reação, a constante de equilíbrio a uma temperatura T é igual a 400.
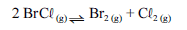
Com base nessa informação e considerando que os logaritmos naturais de 5 e 2 sejam iguais a 1,609 e 0,693, respectivamente, julgue os itens seguintes.
Considerando que a reação seja endotérmica em toda a faixa compreendida entre as temperaturas T e T e que T seja maior que T, é correto concluir que a constante de equilíbrio da reação na temperatura T é superior a 400.
- C. Certo
- E. Errado
Para a seguinte reação, a constante de equilíbrio a uma temperatura T é igual a 400.
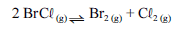
Com base nessa informação e considerando que os logaritmos naturais de 5 e 2 sejam iguais a 1,609 e 0,693, respectivamente, julgue os itens seguintes.
Se 10,0 mol de BrCR(g) forem colocados em uma câmara inicialmente evacuada, quando o equilíbrio químico for atingido, à temperatura T, a quantidade de matéria de Br2 será inferior a 6,0 mol.
- C. Certo
- E. Errado
Para a seguinte reação, a constante de equilíbrio a uma temperatura T é igual a 400.
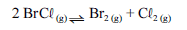
Com base nessa informação e considerando que os logaritmos naturais de 5 e 2 sejam iguais a 1,609 e 0,693, respectivamente, julgue os itens seguintes.
Na temperatura T, a energia livre padrão da reação apresentada é negativa, e o valor de seu módulo é superior a 5RT.
- C. Certo
- E. Errado
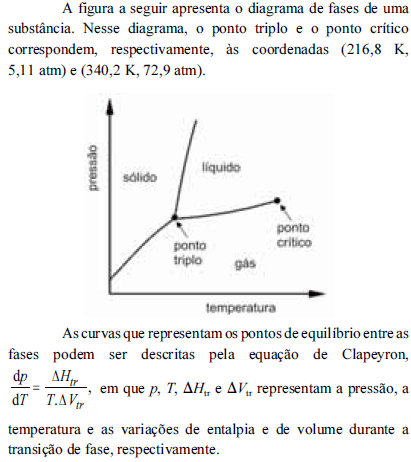
A partir do diagrama apresentado e com base na equação de Clapeyron, é correto inferir que
na temperatura de fusão, a fase sólida da substância em apreço apresenta densidade maior que a do respectivo estado líquido.
- C. Certo
- E. Errado
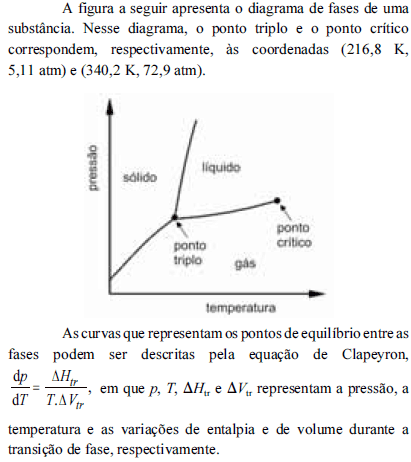
A partir do diagrama apresentado e com base na equação de Clapeyron, é correto inferir que
à pressão de 1 atm, a referida substância pode sofrer sublimação.
- C. Certo
- E. Errado
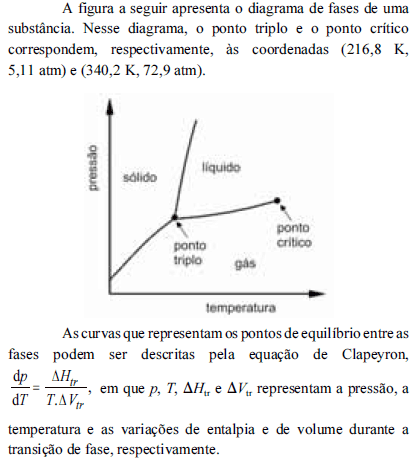
A partir do diagrama apresentado e com base na equação de Clapeyron, é correto inferir que
à temperatura de 280 K, a pressão de vapor dessa substância é maior que 72,9 atm.
- C. Certo
- E. Errado


