Questões de Engenharia Química do ano 2011
Lista completa de Questões de Engenharia Química do ano 2011 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.

- A.
90,0%
- B.
92,5%
- C.
93,5%
- D.
94,0%
- E.
95,0%
Em relação à primeira lei e à segunda lei da termodinâmica, analise as afirmações a seguir.
I - A primeira lei da termodinâmica estabelece que a variação de energia interna em um sistema é igual à diferença entre o calor e o trabalho no eixo realizado.
II - Em um ciclo termodinâmico para transformação de calor em trabalho, o calor absorvido e o trabalho realizado são grandezas numericamente iguais, obedecendo dessa forma, ao princípio da conservação da energia.
III - De acordo com a segunda lei da termodinâmica, é inviável a realização de um ciclo termodinâmico capaz de transferir calor de um ambiente a baixa temperatura para um ambiente a uma temperatura mais elevada.
IV - A entropia é uma função de estado cuja variação diferencial pode ser caracterizada por meio da razão entre o calor trocado e a temperatura, ao longo de uma trajetória reversível.
V - A segunda lei da termodinâmica impõe que, em um sistema isolado, as variações de entropia serão sempre positivas ou nulas.
São corretas APENAS as afirmativas
- A.
I e II.
- B.
I e V.
- C.
II e III.
- D.
III e IV.
- E.
IV e V.

Com base nos dados acima, analise as afirmativas a seguir.
I - A vazão molar de metanol produzido é de 4,8 mol/s.
II - A fração molar de metanol na corrente de produto D é de 0,50.
III - A razão molar N2 / (CO2+H2) na corrente de purga P é de 0,10.
Está correto o que se afirma em
- A.
I, apenas.
- B.
I e II, apenas.
- C.
I e III, apenas.
- D.
II e III, apenas.
- E.
I, II e III.
Considerando-se que a razão molar de reciclo (R/F), expressa apenas em termos de CO2 e H2, é de 0,6, analise as afirmativas abaixo:
I - A conversão de CO2 por passagem no reator é de 60%.
II - A vazão molar de (CO2 + H2) na carga combinada é 24 mol/s.
III - A razão molar de N2 na corrente de carga combinada (CC) é de 0,10.
Está correto o que se afirma em
- A.
I, apenas.
- B.
I e II, apenas.
- C.
I e III, apenas.
- D.
II e III, apenas.
- E.
I, II e III.
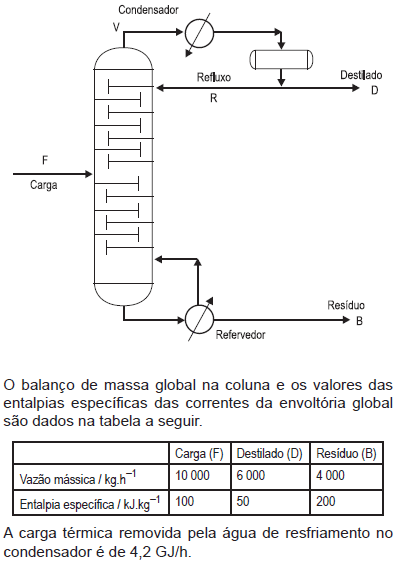
Considere que a entalpia de vaporização do destilado é 200 kJ/kg. Para as condições definidas na tabela e de acordo com as informações dadas, a razão de refluxo de operação é
- A.
3,0
- B.
2,5
- C.
2,0
- D.
1,5
- E.
1,0
Considere que a entalpia de vaporização do vapor d´água usada no refervedor seja de 2 000 kJ/kg. Para as condições definidas na tabela e de acordo com as informações dadas, a vazão de vapor d´água consumida no refervedor é
- A.
1 950 kg/h
- B.
2 000 kg/h
- C.
2 050 kg/h
- D.
2 100 kg/h
- E.
2 150 kg/h
Uma determinada massa de gás ideal, inicialmente a uma pressão e temperatura Pi e Ti, é submetida a um processo de alteração de suas variáveis de estado até que estas atinjam novos valores Pf e Tf. Esse processo é baseado em duas etapas em sequência:
1a Aquecimento à pressão constante até atingir a temperatura Tf.
2a Compressão isotérmica do gás até atingir uma pressão Pf.
Considerando-se que a capacidade calorífica à pressão constante (Cp) mantém o mesmo valor ao longo do processo, a variação da energia interna do sistema é igual a
- A.
CpTf
- B.
Cp(Tf Ti)
- C.
RTf RTi
- D.
CpTf RTi) + (CpTi RTf)
- E.
(CpTf + RTi) (CpTi + RTf)
As propriedades termodinâmicas dos fluidos: energia interna, entalpia e entropia específicas podem ser calculadas a partir das propriedades temperatura, pressão e volume específico, que são mensuráveis. Se for escolhida adequadamente a dependência dessas propriedades, relações importantes podem ser obtidas. Definindo-se a dependência: h = h(s,p), a seguinte expressão é obtida:
- A.

- B.

- C.

- D.

- E.

Em relação ao comportamento volumétrico de fluidos, é INCORRETO afirmar que
- A.
todos os fluidos têm o mesmo fator de compressibilidade, à mesma temperatura e pressão reduzidas, de acordo com o princípio dos estados correspondentes.
- B.
o fator de compressibilidade (z) pode assumir valores iguais a 1, maiores do que 1 ou menores do que 1.
- C.
o fator de compressibilidade (z) é adimensional.
- D.
as substâncias apolares em qualquer temperatura e pressão se comportam como um gás ideal.
- E.
as densidades do líquido e do gás tornam-se idênticas no estado crítico.

- A.

- B.

- C.

- D.

- E.



