Questões de Engenharia Química do ano 2015
Lista completa de Questões de Engenharia Química do ano 2015 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.

Com relação a essa situação hipotética, julgue os itens subsequentes, considerando que a combustão do CH4 ocorra de forma completa; que a entalpia padrão de combustão do CH4 (g), a 25 ºC, seja igual a -890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
A combustão de um mol de CH4 (g), em condições padrão a 25 ºC, gera uma redução de mais de 1.000 kJ na energia livre de Gibbs do sistema.- C. Certo
- E. Errado

Com relação a essa situação hipotética, julgue os itens subsequentes, considerando que a combustão do CH4 ocorra de forma completa; que a entalpia padrão de combustão do CH4 (g), a 25 ºC, seja igual a -890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
Considerando-se que as capacidades caloríficas fornecidas na tabela sejam válidas para o intervalo de temperaturas entre 25 ºC e 35 ºC, é correto afirmar que a combustão do CH4 (g) deverá liberar maior quantidade de calor se for realizada a 35 ºC, e não a 25 ºC.- C. Certo
- E. Errado

Com relação a essa situação hipotética, julgue os itens subsequentes, considerando que a combustão do CH4 ocorra de forma completa; que a entalpia padrão de combustão do CH4 (g), a 25 ºC, seja igual a -890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
Considerando-se um comportamento ideal para a mistura sob pressão total p, é correto afirmar que, em uma amostra de gás natural constituída por 95%, em massa, de metano e, o restante, de etano, a pressão parcial do metano será superior a 0,95p.- C. Certo
- E. Errado

Com relação a essa situação hipotética, julgue os itens subsequentes, considerando que a combustão do CH4 ocorra de forma completa; que a entalpia padrão de combustão do CH4 (g), a 25 ºC, seja igual a -890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
Se o consumo mensal de energia elétrica da referida empresa for de 1,0 × 1012 J, a combustão do CH4 (g), sob pressão constante de 1 bar e a 25 ºC, produzirá mais de 40 toneladas de CO2 para suprir as necessidades mensais de energia da empresa.- C. Certo
- E. Errado
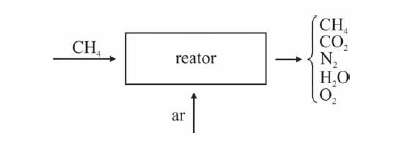
Em um reator ideal, de processo contínuo, que opera em estado estacionário, a combustão de CH4 ocorre com uma conversão de 90% do reagente limitante. Esse reator é alimentado com CH4 e ar a taxas de 16 kg/h e 300 kg/h, respectivamente, conforme ilustrado no esquema apresentado.
Considerando que, nessa situação, a combustão do CH4 seja completa e que a composição do ar que alimenta o reator seja de 24%, em massa, de O2 (g) e, o restante, de N2 (g), julgue o item subsequente.
A porcentagem, em massa, de CO2 na corrente de saída do reator é superior a 10%.- C. Certo
- E. Errado
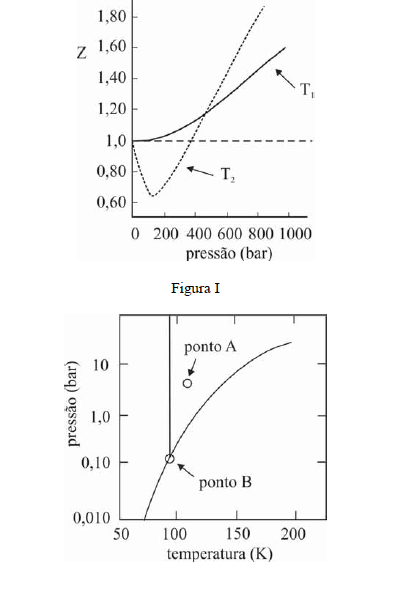
A figura I ilustra o gráfico do coeficiente de compressibilidade (Z) do CH4 (g) em função da pressão para duas temperaturas distintas (T1 e T2), e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue os itens que se seguem.
Na temperatura T2, o CH4 (g), a 200 bar de pressão, ocupará um volume superior ao estimado pela equação dos gases ideais, o que demonstra que as forças atrativas predominam sobre as forças repulsivas.- C. Certo
- E. Errado
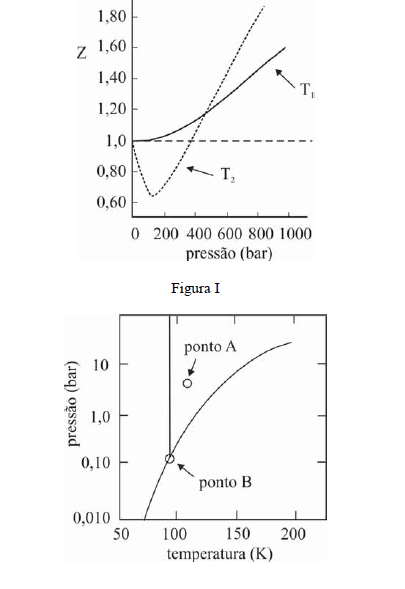
A figura I ilustra o gráfico do coeficiente de compressibilidade (Z) do CH4 (g) em função da pressão para duas temperaturas distintas (T1 e T2), e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue os itens que se seguem.
Infere-se da situação mostrada na figura I que T1 é maior que T2.- C. Certo
- E. Errado
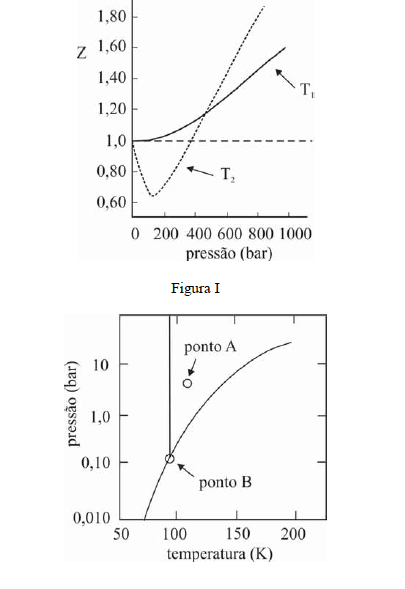
A figura I ilustra o gráfico do coeficiente de compressibilidade (Z) do CH4 (g) em função da pressão para duas temperaturas distintas (T1 e T2), e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue os itens que se seguem.
O CH4 não pode ser liquefeito por simples compressão à temperatura de 150 K, uma vez que o ponto B, na figura II, corresponde à temperatura crítica desse gás.- C. Certo
- E. Errado
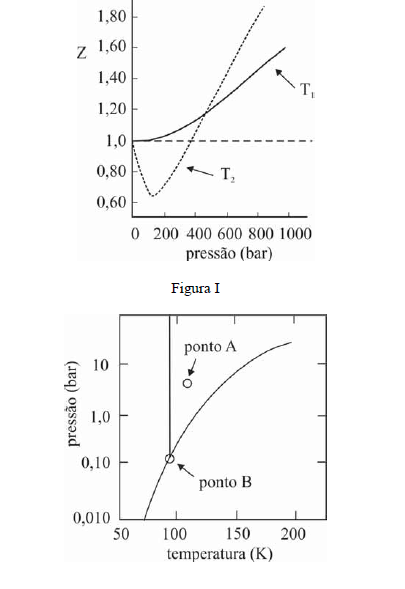
A figura I ilustra o gráfico do coeficiente de compressibilidade (Z) do CH4 (g) em função da pressão para duas temperaturas distintas (T1 e T2), e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue os itens que se seguem.
Na temperatura e pressão correspondentes ao ponto A da figura II, o potencial químico do metano gasoso é superior ao do metano líquido.- C. Certo
- E. Errado
Uma célula eletroquímica realiza a eletrólise de uma solução aquosa de NaCl operando com uma corrente constante de 100,0 A e com rendimento de 100% para a formação de Cl2. Considerando que a massa molar do Cl2 seja igual a 70,9 g/mol e que a constante de Faraday seja igual a 96.500 C/mol, julgue os próximos itens. O tempo necessário para a formação de 709 g de Cl2, a partir da eletrólise da solução aquosa de NaCl, é superior a 2 h.
- C. Certo
- E. Errado


