Questões de Engenharia Química da Centro de Seleção e de Promoção de Eventos UnB (CESPE)
Lista completa de Questões de Engenharia Química da Centro de Seleção e de Promoção de Eventos UnB (CESPE) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Para a seguinte reação, a constante de equilíbrio a uma temperatura T é igual a 400.
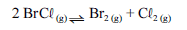
Com base nessa informação e considerando que os logaritmos naturais de 5 e 2 sejam iguais a 1,609 e 0,693, respectivamente, julgue os itens seguintes.
Na temperatura T, a energia livre padrão da reação apresentada é negativa, e o valor de seu módulo é superior a 5RT.
- C. Certo
- E. Errado
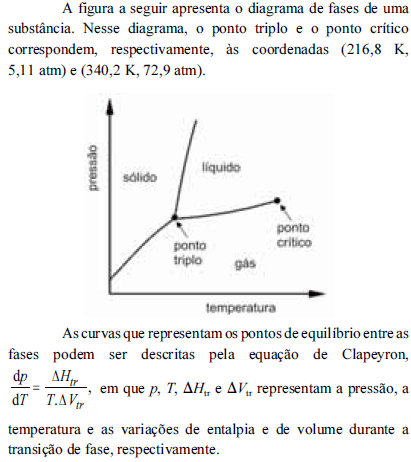
A partir do diagrama apresentado e com base na equação de Clapeyron, é correto inferir que
na temperatura de fusão, a fase sólida da substância em apreço apresenta densidade maior que a do respectivo estado líquido.
- C. Certo
- E. Errado
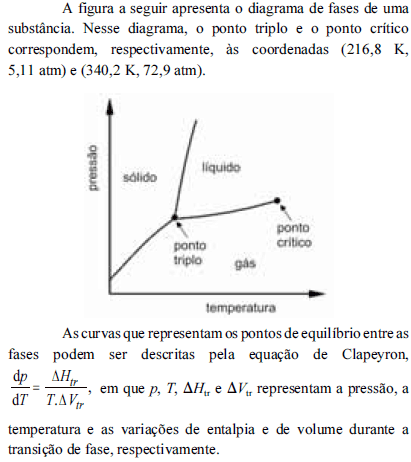
A partir do diagrama apresentado e com base na equação de Clapeyron, é correto inferir que
à pressão de 1 atm, a referida substância pode sofrer sublimação.
- C. Certo
- E. Errado
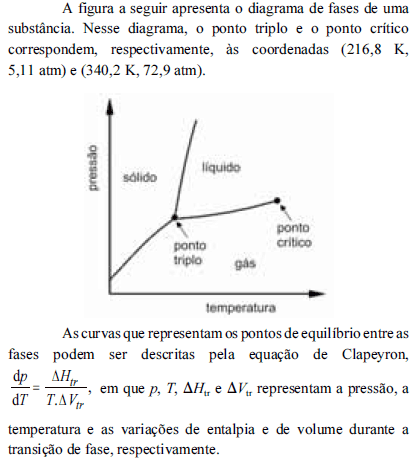
A partir do diagrama apresentado e com base na equação de Clapeyron, é correto inferir que
à temperatura de 280 K, a pressão de vapor dessa substância é maior que 72,9 atm.
- C. Certo
- E. Errado
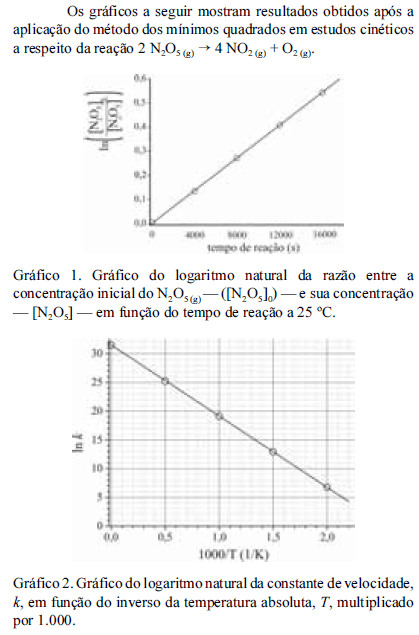
Considerando as informações fornecidas e que a constante dos gases ideais seja igual a 8,3 .J.mol -1 K -1, julgue os próximos itens.
A energia de ativação da reação em questão é maior que 80 kJ/mol.
- C. Certo
- E. Errado
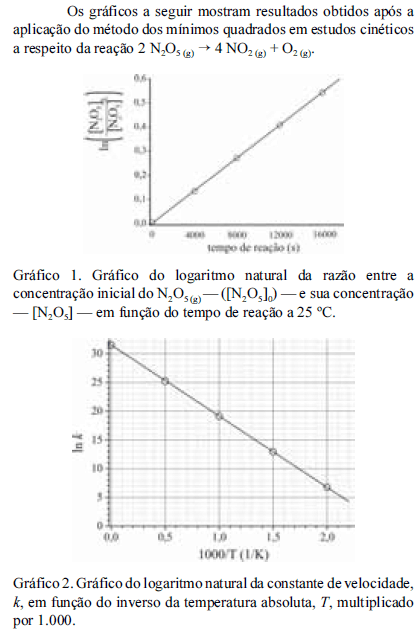
Considerando as informações fornecidas e que a constante dos gases ideais seja igual a 8,3 .J.mol -1 K -1, julgue os próximos itens.
A reação em questão apresenta cinética de segunda ordem.
- C. Certo
- E. Errado

Considerando as informações acima e que pH = -log ah , em que H+ a representa a atividade dos íons H+ na solução, julgue os itens H+ que se seguem.
Em uma peça de aço inoxidável, a proteção contra a corrosão ocorre porque o cromo apresenta menor tendência eletroquímica à oxidação que o ferro.
- C. Certo
- E. Errado

Considerando as informações acima e que pH = -log ah , em que H+ a representa a atividade dos íons H+ na solução, julgue os itens H+ que se seguem.
A partir dos dados fornecidos, infere-se que o potencial-padrão, a 25 ºC, para a reação Fe3+ + 3 e- → Fe é maior que 1,0 V.
- C. Certo
- E. Errado

Considerando as informações acima e que pH = -log ah , em que H+ a representa a atividade dos íons H+ na solução, julgue os itens H+ que se seguem.
O potencial-padrão para a reação de corrosão do ferro apresentada, a 25 ºC, é maior que 2,0 V.
- C. Certo
- E. Errado

Considerando as informações acima e que pH = -log ah , em que H+ a representa a atividade dos íons H+ na solução, julgue os itens H+ que se seguem.
Em pH 4,0, o potencial elétrico para a referida reação de corrosão do ferro supera, em valor igual a 6,9RT/F, o potencial medido em pH 7,0, considerando-se constantes as atividades de Fe2+ e O2 e a temperatura.
- C. Certo
- E. Errado


