Questões de Química
Lista completa de Questões de Química para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Nos séculos XVIII e XIX, apesar do grande interesse pelos fenômenos elétricos, a natureza da eletricidade não estava esclarecida. Nesse sentido, etapas importantes foram dadas pelo cientista inglês Michael Faraday, que, por meio de seus experimentos de eletrólise, introduziu a nomenclatura para designar os polos opostos presentes no sistema eletrolítico (ânodo e cátodo) e estabeleceu o grau de afinidade química de dois elementos. Desse modo, a maior contribuição desse cientista relativa à natureza elétrica da matéria foi
- A.
estabelecer a terapêutica baseada na eletricidade ou eletricidade médica.
- B.
propor o sistema dualístico, segundo o qual átomos com mesmo tipo de carga elétrica não poderiam se combinar.
- C.
enunciar as leis da estequiometria eletroquímica, provendo a correspondência quantitativa entre ação elétrica e eventos químicos.
- D.
fabricar a primeira pilha elétrica.
- E.
inventar a primeira máquina a produzir eletricidade.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013

- A.
140,0.
- B.
175,0.
- C.
280,0.
- D.
310,3.
- E.
840,0.
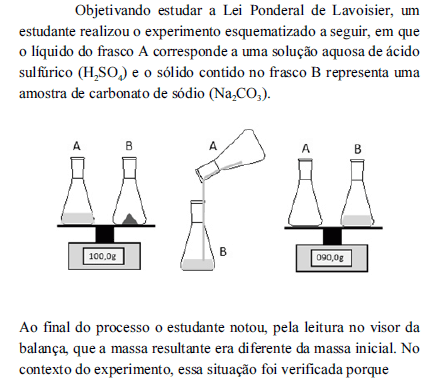
- A.
houve excesso de um dos reagentes empregados, o que não é previsto pela Lei de Lavoisier.
- B.
é necessário que o sistema seja fechado, o que não ocorreu no experimento realizado pelo estudante.
- C.
os reagentes devem se encontrar na mesma fase de agregação, o que não ocorreu no experimento realizado pelo estudante.
- D.
a Lei de Lavoisier não é válida para reações efetuadas em soluções aquosas.
- E.
a Lei de Lavoisier só é válida nas condições padrão de temperatura e pressão.

- A.

- B.

- C.

- D.

- E.

Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
Ao longo do tempo, o conceito de elemento químico se modificou. Desse modo, atualmente, define-se elemento químico como
- A.
uma substância simples, fundamental e elementar.
- B.
um tipo de átomo caracterizado por um número de massa específico.
- C.
uma substância que não pode ser decomposta em outras mais simples.
- D.
um grupo de átomos ou íons isoeletrônicos.
- E.
um conjunto de átomos e íons isótopos entre si.
Química - Reações, Soluções e Transformações Químicas - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013

- A.
[H2O]2 [Cl2]2 / [HCl]4 [O2].
- B.
[HCl]4 [O2] / [H2O]2 [Cl2]2.
- C.
[H2O] [Cl2] / [HCl] [O2].
- D.
[HCl] [O2] / [H2O] [Cl2].
- E.
[Cl2] / [HCl] [O2].
Química - Práticas Laboratoriais em química - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
Um técnico precisa montar um sistema para destilação fracionada para separar os componentes de uma mistura de solventes.
Da relação de peças de vidro que ele solicita ao almoxarifado, é necessário que constem- A.
balão volumétrico e condensador de bolas.
- B.
coluna de fracionamento e funil de separação.
- C.
condensador de bolas e termômetro de mercúrio.
- D.
coluna de fracionamento e termômetro graduado.
- E.
balão de fundo chato e erlemmeyer de vidro refratário.
Química - Eletroquímica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
Na eletrólise de uma solução aquosa de 1,0 mol/L de NaI, formam-se bolhas de gás em um dos eletrodos e, no outro, observa-se a formação de uma substância de cor castanho avermelhada.
Nesse sistema, a semirreação no cátodo é escrita como- A.
2I → I2 + 2e-
- B.
Na+ + e → Na
- C.
I2 + 2e → 2 I
- D.
H2O + ½ O2 → 2H+ + 2e
- E.
2H2O + 2e → H2 + 2OH
Química - Práticas Laboratoriais em química - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
Um professor solicitou que fossem preparados e colocados sobre a mesa da sala de aula, cinco frascos limpos, contendo:
18,0 g de água; 27,0 g de alumínio em pó; 55,8 g de limalha de ferro; 63,5 g de cobre granulado; 249,7 g de sulfato de cobre pentahidratado. Em seguida, o professor perguntou aos alunos quais os frascos que apresentavam um número de átomos maior do que 6,02 x1023. Responderam corretamente os que indicaram- A.
água e limalha de ferro.
- B.
água e cobre granulado.
- C.
limalha de ferro e cobre granulado.
- D.
água e sulfato de cobre pentahidratado.
- E.
alumínio em pó e sulfato de cobre pentahidratado.
Química - Reações, Soluções e Transformações Químicas - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
O carvão ativo é uma material aplicado na redução de cor de produtos alimentícios e bebidas. O fenômeno que permite utilizar o carvão ativo para descolorir soluções é denominado
- A.
partição.
- B.
filtração.
- C.
adsorção.
- D.
absorção.
- E.
dissolução.


