Questões de Química
Lista completa de Questões de Química para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013

- A.
adicionar fitas de magnésio ao frasco reacional.
- B.
utilizar zinco em pó em lugar de uma placa de zinco.
- C.
dobrar a concentração de HCl (aq) que está sendo empregado.
- D.
substituir a solução de ácido clorídrico por solução de ácido acético.
- E.
aquecer o sistema reacional de modo a elevar a temperatura em 20 ºC.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
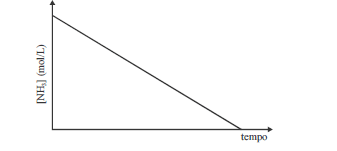
O processo de Haber-Bosh, que opera em altas temperaturas e altas pressões, é bastante utilizado para a produção industrial da amônia (NH3). Nesse processo, os gases nitrogênio (N2) e hidrogênio (H2) reagem exotérmica e reversivelmente para formar amônia gasosa (NH3). No processo inverso, a reação de decomposição da amônia em nitrogênio e hidrogênio em superfície de platina apresenta cinética que segue comportamento conforme representado no gráfico acima, que mostra a variação da concentração molar da amônia gasosa [NH3] em função do tempo. Acerca dessas reações, julgue os itens a seguir.

- C. Certo
- E. Errado
Química - Práticas Laboratoriais em química - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
O técnico do laboratório de análise de água precisa preparar uma solução aquosa de permanganato de potássio, KMnO4 0,0250 mol/L.
Para obter solução, ele deve dissolver e transferir para um balão volumétrico de 1L uma massa de KMnO4 igual a- A.
0,79 g.
- B.
3,95 g
- C.
7,90 g.
- D.
39,50 g.
- E.
79,00 g.
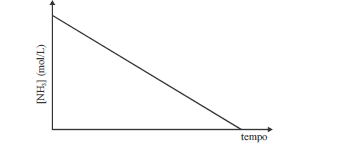
O processo de Haber-Bosh, que opera em altas temperaturas e altas pressões, é bastante utilizado para a produção industrial da amônia (NH3). Nesse processo, os gases nitrogênio (N2) e hidrogênio (H2) reagem exotérmica e reversivelmente para formar amônia gasosa (NH3). No processo inverso, a reação de decomposição da amônia em nitrogênio e hidrogênio em superfície de platina apresenta cinética que segue comportamento conforme representado no gráfico acima, que mostra a variação da concentração molar da amônia gasosa [NH3] em função do tempo. Acerca dessas reações, julgue os itens a seguir.
A partir do gráfico, é correto concluir que a reação envolvida é de ordem zero e que o módulo do valor da inclinação da reta representa a constante de velocidade da reação de consumo da amônia.- C. Certo
- E. Errado
Química - Eletroquímica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013

- A.
ferro e prata.
- B.
ferro e estanho.
- C.
zinco e estanho.
- D.
magnésio e zinco.
- E.
magnésio e prata.
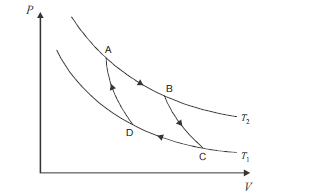
No ciclo de Carnot, ilustrado acima, no gráfico de pressão (P) versus volume (V), ocorrem processos reversíveis que passam pelos estados A, B, C e D. Considerando que as curvas do gráfico apresentam o comportamento de um gás ideal em um sistema fechado, que os processos BC e DA são adiabáticos e que AB e CD são isotérmicos, ocorrendo nas temperaturas T2 e T1, respectivamente, julgue os itens subsequentes.
Nas condições especificadas, se T1 for menor do que T2, o rendimento desse ciclo será de 100%.- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
Paulo elaborou a seguinte relação de situações que observa em seu cotidiano:
o escurecimento do papel de jornal ao longo do tempo; o escurecimento de objetos de prata; o aroma de canela que emana de velas perfumadas acesas em uma sala; o amolecimento de uma sobremesa de gelatina esquecida fora da geladeira. Entre as situações relacionadas, são transformações químicas:- A.
o escurecimento do papel de jornal e o perfume que exala da vela perfumada.
- B.
o perfume que exala da vela perfumada que queima e o amolecimento da gelatina.
- C.
o escurecimento dos objetos de prata e o amolecimento da gelatina.
- D.
o escurecimento do papel de jornal e o amolecimento da gelatina.
- E.
o escurecimento do papel de jornal e dos objetos de prata.
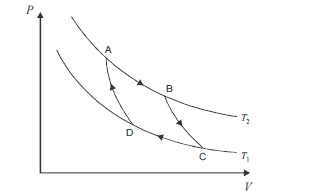
No ciclo de Carnot, ilustrado acima, no gráfico de pressão (P) versus volume (V), ocorrem processos reversíveis que passam pelos estados A, B, C e D. Considerando que as curvas do gráfico apresentam o comportamento de um gás ideal em um sistema fechado, que os processos BC e DA são adiabáticos e que AB e CD são isotérmicos, ocorrendo nas temperaturas T2 e T1, respectivamente, julgue os itens subsequentes.
O trabalho e o calor não são funções de estado, diferentemente da energia interna, que depende somente do estado em que se encontra o sistema.- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
Uma amostra de 20,0 g de um material contendo CaMg(CO3)2 foi titulada com 65,25 m de HCl 0,250 mol/L.
A percentagem de carbonato de cálcio e magnésio na amostra analisada é, aproximadamente, igual a- A.
3,8.
- B.
7,6.
- C.
16,3.
- D.
28,4.
- E.
32,6.
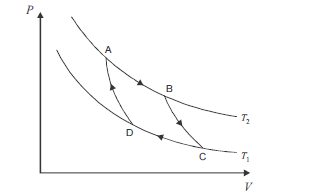
No ciclo de Carnot, ilustrado acima, no gráfico de pressão (P) versus volume (V), ocorrem processos reversíveis que passam pelos estados A, B, C e D. Considerando que as curvas do gráfico apresentam o comportamento de um gás ideal em um sistema fechado, que os processos BC e DA são adiabáticos e que AB e CD são isotérmicos, ocorrendo nas temperaturas T2 e T1, respectivamente, julgue os itens subsequentes.
A variação da entropia para o sistema e suas vizinhanças, após o gás percorrer o ciclo acima e retornar ao estado inicial A, é nula.- C. Certo
- E. Errado


