Questões de Química
Lista completa de Questões de Química para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.

- A.
I e II.
- B.
I e IV.
- C.
II e III.
- D.
I, III e IV.
- E.
II, III e IV.
Uma amostra de 20 mL de sulfato de ferro (II) e de amônio 0,1 M foi analisada por titulação potenciométrica com uma solução de sulfato de cério (IV) 0,1095 M, usando-se eletrodos de platina e de calomelano saturado. Observando essa análise potenciométrica, analise as afirmativas abaixo.
I - O eletrodo de calomelano é um eletrodo de referência e é composto de mercúrio e cloreto de mercúrio (I), cobertos com uma solução de cloreto de potássio saturada.
II - Nessa análise potenciométrica, o cério se oxida a Ce3+, e o ferro se reduz a Fe3+.
III - Trata-se de uma potenciometria direta, e o eletrodo indicador é a platina.
Está correto o que se afirma em
- A.
I, apenas.
- B.
II, apenas.
- C.
I e III, apenas.
- D.
II e III, apenas.
- E.
I, II e III.
Considere que, no início do experimento, em vez de 56 g de but-1-eno, foram utilizados 56 g de monóxido de carbono. Os gases nitrogênio e monóxido de carbono não reagem entre si e apresentam comportamento ideal. Na câmara P, antes da Válv. 2 ser aberta, a temperatura do sistema era, também, de 300 K, e a pressão medida do sistema foi de P2. A relação entre as pressões, utilizando o but-1-eno, P1, e o monóxido de carbono, P2, é
- A.
P1 = P2
- B.
P1 = 2P2
- C.
2P1 = P2
- D.
2P1 = 3P2
- E.
3P1 = 2P2
Analise as afirmativas abaixo sobre as determinações analíticas quantitativas com base na Espectroscopia por Adsorção Molecular.
I - O método utilizado para a determinação quantitativa da concentração de uma substância através da absorção da radiação é baseada na Lei de Beer-Lambert.
II - A Lei de Beer é limitada a soluções diluídas porque considera que há interações dos centros absorventes com outras espécies presentes nestas soluções.
III - A Lei de Beer se aplica a soluções concentradas porque a interação entre as moléculas não afeta a distribuição de cargas na espécie absorvente, o que alteraria o coefi ciente de absortividade molar.
IV - Desvios químicos da Lei de Beer ocorrem quando um analito se dissocia, se associa ou reage com um solvente gerando um produto cujo espectro de absorção é diferente do analito.
Está correto APENAS o que se afirma em
- A.
I
- B.
I e II
- C.
I e IV
- D.
II e III
- E.
III e IV
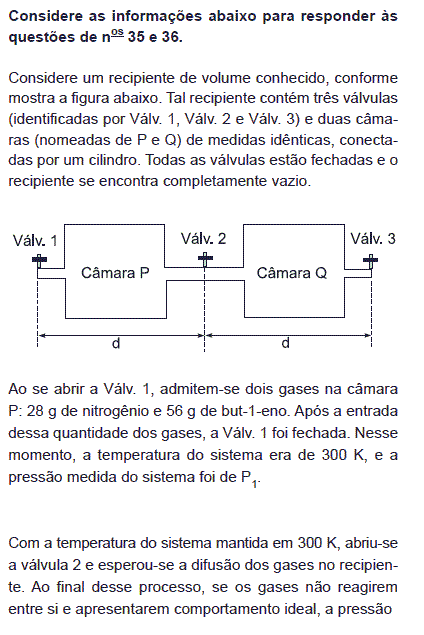
- A.
final do sistema será igual a P1.
- B.
final do sistema será igual ao dobro de P1.
- C.
parcial dos dois gases permanecerá constante.
- D.
parcial do gás nitrogênio será quatro vezes menor que P1.
- E.
parcial do but-1-eno será o dobro da do nitrogênio.
Um químico, responsável pela análise de metais em amostras sólidas, recebeu uma amostra de solo contaminado com cobre, cuja contaminação foi provocada por um vazamento de uma solução industrial altamente concentrada. Pesou-se 1 g (base seca) da amostra, a qual foi digerida em 10 mL de HNO3 em forno de micro-ondas. Após a abertura, a amostra foi quantitativamente transferida para um balão volumétrico de 50 mL e avolumada. Em seguida, transferiu-se um volume de 5 mL para um outro balão volumétrico de 50 mL. Essa última amostra foi analisada em um Espectrofotômetro de Absorção Atômica (EAA) com lâmpada de catodo oco específico de cobre, obtendo-se média da medida da absorvância igual a 0,300. Qual a quantidade de cobre na amostra, em mg/g, considerando a curva padrão igual a Abs = 0,006[Cu2+]?
Obs.: Abs = Absorvância coeficiente de correlação R2 = 0,9999
- A.
25
- B.
20
- C.
15
- D.
10
- E.
5

- A.
4,7
- B.
7,0
- C.
8,8
- D.
9,3
- E.
13,0
O teor de peróxido de hidrogênio em água oxigenada pode ser determinado por titulação com solução de permanganato de potássio, tanto em meio ácido como em meio alcalino. Se a titulação de uma determinada amostra consumiu 12,6 mL de solução de KMnO4 0,1N, quando conduzida em meio ácido, qual seria o consumo esperado, em mL, caso a titulação fosse conduzida em meio alcalino?
- A.
25,2
- B.
21,0
- C.
12,6
- D.
6,3
- E.
4,2
O carbono apresenta três isótopos, sendo o mais abundante o de massa 12. O menos abundante, o isótopo carbono- 14 (14C), é utilizado para datação de fósseis e artefatos de civilizações antigas. A quantidade de carbono-14 cai pela metade a cada 5.700 anos, aproximadamente. Desse modo, com a medição da quantidade de carbono- 14 restante na amostra, é possível determinar a idade do fóssil ou da fabricação de um objeto. Sendo k a constante de velocidade, a lei de velocidade do decaimento radioativo do carbono-14 é representada pela equação
- A.
v = k. [14C]0
- B.
v = k.[14C]1/2
- C.
v = k. [14C]
- D.
v = k. ½. [14C]
- E.
v = k. [14C]2

- A.
é uma oxirredução, e o elemento oxidado é o Na.
- B.
é uma oxirredução, e o elemento oxidado é o O.
- C.
é uma oxirredução, e o elemento oxidado é o H.
- D.
é uma oxirredução, e o elemento oxidado é o Cl.
- E.
não é uma oxirredução, portanto, nenhum elemento é oxidado.


