Questões de Química do ano 2006
Lista completa de Questões de Química do ano 2006 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Práticas Laboratoriais em química - Instituto de Planejamento e Apoio ao Desenvolvimento Tecnológico e Científico (IPAD) - 2006
Como uma das formas de se obter maior segurança em um laboratório, recomenda-se sinalizar as tubulações com cores-padrão. Estabeleça a relação entre tipo e cor-padrão de tubulação, numerando a segunda coluna de acordo com a primeira.
A seqüência correta de cima para baixo é:
- A.
1, 3, 2 e 4.
- B.
1, 2, 4 e 3.
- C.
2, 4, 1 e 3.
- D.
2, 1, 4 e 3.
- E.
1, 4, 2 e 3.
Química - Práticas Laboratoriais em química - Instituto de Planejamento e Apoio ao Desenvolvimento Tecnológico e Científico (IPAD) - 2006
As obtenções de resultados experimentais em análises químicas estão condicionadas a vários fatores, tais como "erros". Os erros ocorridos em uma análise titrimétrica decorrentes de reações que não se completaram e da diferença entre o ponto final que se observa e o ponto de equivalência estequiométrico da reação são classificados como:
- A.
erros operacionais.
- B.
erros de método.
- C.
erros instrumentais.
- D.
erros conformacionais.
- E.
erros aleatórios.
Química - Práticas Laboratoriais em química - Instituto de Planejamento e Apoio ao Desenvolvimento Tecnológico e Científico (IPAD) - 2006
Diversas análises químicas baseiam-se na determinação exata da massa de uma amostra ou da massa de um sólido obtido da amostra. Por isso, um dos procedimentos mais comuns efetuados em laboratórios de análise química é o da medida de uma massa. Dentre as alternativas abaixo, qual se aplica ao manuseio de uma balança analítica eletrônica?
- A.
Manter a temperatura do objeto a ser pesado um pouco abaixo da temperatura da balança.
- B.
Manter a temperatura do objeto a ser pesado um pouco acima da temperatura da balança.
- C.
Remover a poeira do prato com um pincel de pêlos de camelo.
- D.
Pesar líquidos voláteis em frascos abertos.
- E.
Deixar um vidro de relógio sobre o prato, após terminar a pesagem.
Química - Práticas Laboratoriais em química - Instituto de Planejamento e Apoio ao Desenvolvimento Tecnológico e Científico (IPAD) - 2006
A seguir, são dadas as características de três tipos de vidrarias diferentes: 1, 2 e 3.
1. Utilizados em processos que ocorrem reações entre soluções.
2. Usados na extração líquido-líquido.
3. Empregados em análises e evaporações Pode-se afirmar que 1, 2 e 3,
são respectivamente:
- A.
béquer, proveta e funil de separação.
- B.
erlenmeyer, funil de separação e vidro de relógio.
- C.
béquer, proveta e balão de destilação.
- D.
béquer, balão volumétrico e balão de destilação.
- E.
erlenmeyer, balão volumétrico e vidro de relógio.
Uma certa quantidade de um gás ideal percorre o ciclo 1-2-3-1, cuja dependência do volume, em relação à temperatura, está representada pelo gráfico abaixo. A dependência da pressão em relação ao volume para este ciclo é representada por: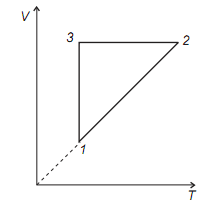
- A.

- B.

- C.

- D.

- E.

De modo a caracterizar o estado termodinâmico de uma substância pura deve-se conhecer o valor de duas propriedades termodinâmicas. Nessa perspectiva, está correto afirmar que as duas variáveis que são definidas como propriedades termodinâmicas são:
- A.
calor e trabalho.
- B.
calor e energia interna.
- C.
calor e entropia.
- D.
entalpia e entropia.
- E.
trabalho e entalpia.
O cobre pode ser obtido a partir da reação da calcosita (Cu2
com a cuprita (Cu2 O), conforme a reação abaixo.
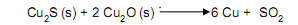
Ao reagir 260g de cuprita contendo 45% de impureza
com calcosita suficiente, foram obtidos 152,4g de cobre.
O rendimento da reação foi de:
(Dados - Massa molares: Cu = 63,5g/mol; S = 32 g/mol;
O = 16 g/mol)
- A.
100%
- B.
95%
- C.
90%
- D.
80%
- E.
75%
A mistura de pó de alumínio, perclorato de amônio e óxido de ferro III é utilizada como combustível sólido na impulsão dos foguetes de lançamento do ônibus espacial. Uma das reações que ocorrem quando essa mistura é inflamada está representada na equação não balanceada abaixo. A respeito dessa reação e das espécies envolvidas é correto afirmar que o(a):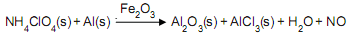
- A. Al sofre redução.
- B. NO é um óxido básico.
- C.
NH4
ClO4 é um sal oriundo de ácido forte e oxidante. - D.
Al2
O3 e o Fe2 O3 apresentam propriedades anfotéricas. - E.
soma dos coeficientes mínimos para essa equação é 15.
O elemento cálcio é encontrado em abundância na forma de carbonato de cálcio e cloreto de cálcio, na crosta terrestre e na água do mar, respectivamente. Para obtenção de cálcio metálico a partir desses sais, foram propostos os seguintes métodos:
I - redução do carbonato de cálcio com carvão;
II - eletrólise ígnea do cloreto de cálcio;
III - redução do cloreto de cálcio com sódio;
IV - eletrólise ígnea do carbonato de cálcio.
Estão corretas, apenas, as proposições:
- A.
I e II.
- B.
I e III.
- C.
II e III.
- D.
II e IV.
- E.
III e IV.
Considere as moléculas abaixo, que representam espécies orgânicas encontradas em petróleos.
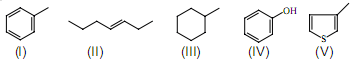
- A.
I é menos reativo que II quando submetido a um processo de craqueamento catalítico.
- B.
I e IV são os únicos compostos aromáticos dentre as espécies apresentadas.
- C.
III apresenta dois estereoisômeros oticamente ativos.
- D.
IV possui ponto de ebulição menor do que V.
- E.
I, IV e V são insolúveis em água.


