Questões de Química do ano 2007
Lista completa de Questões de Química do ano 2007 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
A crescente preocupação mundial com o esgotamento das reservas petrolíferas tem gerado um grande número de pesquisas para a obtenção de energia a partir de outras fontes. Uma dessas alternativas, que está em desenvolvimento, é a utilização de hidrogênio gerado a partir da oxidação do metano, segundo a equação química a seguir.
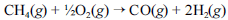
Na tabela a seguir, são fornecidas as entalpias de formação do metano e do monóxido de carbono.

A partir dessas informações, julgue os itens seguintes.
A entalpia da oxidação do metano apresentada é igual à soma da entalpia dos produtos e a dos reagentes dessa reação
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
A crescente preocupação mundial com o esgotamento das reservas petrolíferas tem gerado um grande número de pesquisas para a obtenção de energia a partir de outras fontes. Uma dessas alternativas, que está em desenvolvimento, é a utilização de hidrogênio gerado a partir da oxidação do metano, segundo a equação química a seguir.
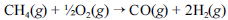
Na tabela a seguir, são fornecidas as entalpias de formação do metano e do monóxido de carbono.

A partir dessas informações, julgue os itens seguintes.
Considerando-se que, à temperatura de 1.300 K e a 1 atm, a entalpia da reação apresentada seja igual a -22 kJ, então é correto concluir que, quanto maior a temperatura, maior é o calor liberado por essa reação, mantida a pressão constante.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
A crescente preocupação mundial com o esgotamento das reservas petrolíferas tem gerado um grande número de pesquisas para a obtenção de energia a partir de outras fontes. Uma dessas alternativas, que está em desenvolvimento, é a utilização de hidrogênio gerado a partir da oxidação do metano, segundo a equação química a seguir.
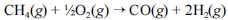
Na tabela a seguir, são fornecidas as entalpias de formação do metano e do monóxido de carbono.

A partir dessas informações, julgue os itens seguintes.
A entalpia da reação apresentada, a 25º C e 1 atm, para a formação de 10 mols de hidrogênio, é igual a -35,68 kJ.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
A crescente preocupação mundial com o esgotamento das reservas petrolíferas tem gerado um grande número de pesquisas para a obtenção de energia a partir de outras fontes. Uma dessas alternativas, que está em desenvolvimento, é a utilização de hidrogênio gerado a partir da oxidação do metano, segundo a equação química a seguir.
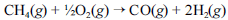
Na tabela a seguir, são fornecidas as entalpias de formação do metano e do monóxido de carbono.

A partir dessas informações, julgue os itens seguintes.
Em qualquer instante em que a reação apresentada no texto se processe, a soma das massas dos produtos e dos reagentes é constante.
- C. Certo
- E. Errado
Necessita-se preparar 250mL de uma solução aquosa 0,1 mol/L de KI, a partir de uma solução aquosa desse sal cuja concentração é de 100 g/L. O volume da solução concentrada, em mL, que deve ser transferido para o balão volumétrico para ser avolumado a 250 mL é de:
- A.
41,5
- B.
63,8
- C.
75,4
- D.
82,7
- E.
104,6
100 mL de uma solução de hidróxido de sódio foram titulados com solução 0,040 mol/L de HC l, consumindo 25,00 mL da solução ácida. O pH original da solução de NaOH é:
- A.
2
- B.
4
- C.
8
- D.
10
- E.
12
O gráfico abaixo representa a reação de oxidação do SO2 para formar SO3 na ausência e na presença de NO2 .
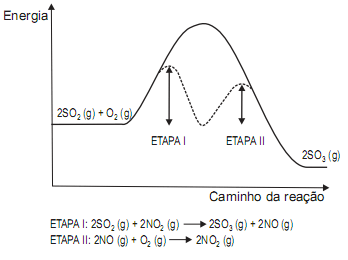
A partir da interpretação do gráfico, é correto afirmar que o(a):
- A.
NO2 age como catalisador, acelera a reação e aumenta a conversão do SO2 em SO3.
- B.
NO2 não é consumido na reação em duas etapas, logo não participa dessa reação de conversão.
- C.
presença do catalisador não afeta o equilíbrio termodinâmico da reação de conversão do SO2 em SO3 .
- D.
reação sem NO2 é mais rápida porque sua energia de ativação é menor do que a soma das energias de ativação das etapas I e II
- E.
reação é exotérmica porque o conteúdo energético do produto é maior do que o dos reagentes.
O petróleo é uma mistura muito complexa formada principal- mente por hidrocarbonetos e por pequenas quantidades de compostos que contêm oxigênio, enxofre e nitrogênio, dentre os quais podem ser citados:

A respeito dessas espécies é correto afirmar que:
- A.
I é um hidrocarboneto aromático.
- B.
I, II e III são compostos heterocíclicos.
- C.
IV é um álcool e II é uma amina terciária.
- D.
IV é o butanotiol e VI é a benzonitrila.
- E.
V pertence às funções cetona e amina.
0,5 mol de uma substância orgânica apresenta 36 g de carbono, 6 mols de átomos de hidrogênio e 9,03 x 1023 átomos de oxigênio. Essa substância apresenta: (Dado: Número de Avogadro = 6,02 x 1023 )
- A.
4,214 x 1024 átomos em 1 mol.
- B.
massa molar de 66 g/mol.
- C.
massa molecular de 132 g.
- D.
órmula mínima C2H4O.
- E.
fórmulas mínima e molecular iguais.
O metanol é preparado cataliticamente a partir de uma mistura de monóxido de carbono e hidrogênio, conforme a reação abaixo, cuja equação não se encontra balanceada.

Considerando-se um excesso de 50% de gás hidrogênio em relação à quantidade estequiométrica e uma conversão de 100%, qual o volume da mistura gasosa, medido em litros nas CNTP, necessário para produzir 1,6 kg de metanol? (Dado: Volume molar nas CNTP = 22,7 L/mol)
- A.
600
- B.
1135
- C.
2170
- D.
3405
- E.
4540


