Questões de Química do ano 2008
Lista completa de Questões de Química do ano 2008 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Aproximadamente 140 milhões de toneladas de gás amoníaco são produzidos anualmente pelo processo de Haber, que combina nitrogênio retirado do ar com gás hidrogênio, conforme representa a equação não-balanceada a seguir. O gás amoníaco é matéria-prima para a produção de ácido nítrico e NH4NO3, este último empregado como fertilizante e explosivo.
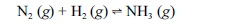
Considerando as informações acima e sabendo que M(H) = 1 g/mol e M(N) = 14 g/mol, julgue os itens a seguir.
Borbulhando-se NH3 em água, a solução resultante forma um ácido de Arrhenius.- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Aproximadamente 140 milhões de toneladas de gás amoníaco são produzidos anualmente pelo processo de Haber, que combina nitrogênio retirado do ar com gás hidrogênio, conforme representa a equação não-balanceada a seguir. O gás amoníaco é matéria-prima para a produção de ácido nítrico e NH4NO3, este último empregado como fertilizante e explosivo.
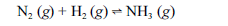
Considerando as informações acima e sabendo que M(H) = 1 g/mol e M(N) = 14 g/mol, julgue os itens a seguir.
Na síntese de NH3, reagentes e produto são moleculares. Nessas substâncias, as ligações entre os átomos são covalentes.- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Aproximadamente 140 milhões de toneladas de gás amoníaco são produzidos anualmente pelo processo de Haber, que combina nitrogênio retirado do ar com gás hidrogênio, conforme representa a equação não-balanceada a seguir. O gás amoníaco é matéria-prima para a produção de ácido nítrico e NH4NO3, este último empregado como fertilizante e explosivo.
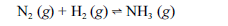
Considerando as informações acima e sabendo que M(H) = 1 g/mol e M(N) = 14 g/mol, julgue os itens a seguir.
Considerando que o NH3 tenha comportamento de gás ideal, em CNTP, o volume de gás amoníaco produzido anualmente é inferior a 200 mil m3.- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Aproximadamente 140 milhões de toneladas de gás amoníaco são produzidos anualmente pelo processo de Haber, que combina nitrogênio retirado do ar com gás hidrogênio, conforme representa a equação não-balanceada a seguir. O gás amoníaco é matéria-prima para a produção de ácido nítrico e NH4NO3, este último empregado como fertilizante e explosivo.
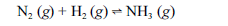
Considerando as informações acima e sabendo que M(H) = 1 g/mol e M(N) = 14 g/mol, julgue os itens a seguir.
Com base no princípio de Avogadro, a reação representada ocorre com contração de volume, visto que para cada 4V de volume dos gases que se combinam formam-se 2V de amônia.- C. Certo
- E. Errado
A iluminação de emergência, que entra em funcionamento quando falta energia elétrica, pode ser alimentada por gerador ou bateria e acumuladores (não automotiva).
- A. 2x.
- B. Zero.
- C. x.
- D. x+3.
Considere as seguintes afirmações:
I. Para cocção, se o equipamento for próprio para queima de gás natural e estiver devidamente calibrado, a chama produzida não provocará fumaça nem sujeira no fundo da panela.
II. Quando se substitui o gás natural pelo gás sintético (mistura de GLP com ar, com o mesmo número de Wöbbe), o PCS do gás sintético é maior do que o PCS do gás natural.
III. Gás Manufaturado é um produto obtido do carvão ou através do craqueamento do gás natural ou da nafta. Seu poder calorífico é semelhante ao do gás natural utilizado no Ceará.
Sobre as três afirmações anteriores, assinale o correto.
- A. Todas são verdadeiras.
- B. Nenhuma delas é verdadeira.
- C. Apenas uma delas é verdadeira.
- D. Apenas duas delas são verdadeiras.
O gás natural como combustível apresenta uma série de vantagens. Assinale a alternativa que NÃO contém uma dessas vantagens.
- A. O gás natural apresenta estabilidade de chama.
- B. A queima do gás natural é isenta de resíduos (baixa poluição).
- C. O gás natural é isento de enxofre, exceto quando na forma de Mercaptan, na odorização.
- D. O uso do gás natural favorece a redução de manutenção de equipamentos e custos operacionais.
Assinale a alternativa que contém uma afirmação verdadeira.
- A. O Ponto de Orvalho auxilia a prever a formação ou não de hidratos.
- B. O Número de cetano indica a capacidade antidetonante do gás natural, semelhantemente à octanagem da gasolina.
- C. O índice de Wobbe é calculado empregando o Poder Calorífico Inferior, em base seca.
- D. O gás odorado não deve apresentar teor de enxofre total inferior a 7 mg/m³ (ANP no 3/2 2).
Em uma eletrólise, uma carga de 10.000 Coulombs levou uma hora para atravessar uma solução de nitrato de prata. Sabendo que o equivalente químico da prata é 107,88 g, a massa de prata depositada no cátodo e a intensidade da corrente são, respectivamente,
- A. 11,177 g e 2,778 A.
- B. 22,354 g e 5,556 A.
- C. 44,708 g e 11,112 A.
- D. 5,558 g e 1,389 A.
O gás natural possui um limite de inflamabilidade que varia de 5% a 15% do volume. Sobre o tema são feitas as seguintes afirmações:
I. A condição não inflamável do meu gás estará entre 0 a 5% de Ar e 95% de GN (mistura pobre em oxidante).
II. A condição não inflamável do meu gás estará entre 15% de Ar e 85% de GN (mistura rica em oxidante).
III. Se, em um ambiente fechado, eu tiver AR e injetar GN o risco da mistura alcançar o limite de inflamabilidade é mais provável do que se o ambiente estiver cheio de GN e eu começar a injetar Ar.
Sobre as três afirmações anteriores, assinale o correto.
- A. Todas as afirmações são falsas.
- B. Todas são verdadeiras.
- C. Apenas a III é verdadeira.
- D. Apenas a I é falsa.


