Questões de Química do ano 2011
Lista completa de Questões de Química do ano 2011 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011
Praticamente dois terços de nosso planeta são cobertos por água. Essa substância é também a mais abundante no organismo humano. Sendo a água tão comum, tem-se a tendência de considerar triviais suas propriedades químicas e físicas. Entretanto, ela possui muitas propriedades não usuais e essenciais à vida na Terra. Uma das propriedades mais importantes da água é a sua capacidade de dissolver uma grande variedade de substâncias. Por essa razão, a água é encontrada na natureza com um vasto número de substâncias nela dissolvidas. Como exemplo dessas substâncias, podem-se citar materiais radioativos, matérias orgânicas, coloides e metais pesados, entre outros.
Tendo o texto acima como referência inicial, julgue os itens a seguir, a respeito de aspectos diversos de química.
Se, após a adição de uma solução de fenolftaleína a uma amostra de água coletada de uma fonte límpida para avaliação de sua acidez, for observada alteração de coloração, indicando caráter ácido, será correto afirmar que o único íon presente na amostra é a espécie H+.
- C. Certo
- E. Errado
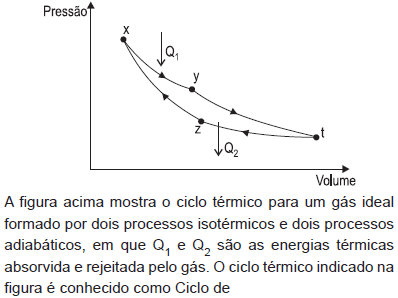
- A.
Rankine
- B.
Otto
- C.
Brayton
- D.
Diesel
- E.
Carnot
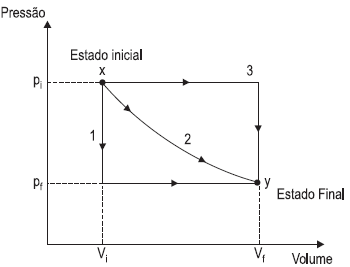
Um gás ideal pode ser levado de seu estado inicial de pressão-volume x a um estado final y, através de três processos diferentes, 1, 2 e 3, conforme indicado no diagrama acima. De acordo com as informações acima, analise as afirmações a seguir. O trabalho realizado pelo gás nos três processos indicados será o mesmo.
PORQUE
O trabalho realizado por um gás depende apenas de seus estados inicial e final de pressão-volume. Analisando-se as afirmações acima, conclui-se que
- A.
as duas afirmações são verdadeiras, e a segunda justifica a primeira.
- B.
as duas afirmações são verdadeiras, e a segunda não justifica a primeira.
- C.
a primeira afirmação é verdadeira, e a segunda é falsa.
- D.
a primeira afirmação é falsa, e a segunda é verdadeira.
- E.
as duas afirmações são falsas.
Uma solução de 1,00 mg de um certo soluto em 50,00 mL tem transmitância igual a 10% a λ = 500 nm e caminho ótico = 20 mm. Sabendo-se que a absortividade molar desse soluto, em 500 nm, é 5,5 .103 L mol−1cm−1, a massa molecular do soluto, em g/mol, é
- A.
2,2.10−2
- B.
1,1.102
- C.
2,2.102
- D.
1,1.103
- E.
2,2.103

- A.
1,0 x 10−5
- B.
1,0 x 10−4
- C.
1,0 x 10−3
- D.
1,0 x 10−2
- E.
1,0 x 10−1
Com relação ao eletrodo padrão de hidrogênio (EPH), considere as afirmativas abaixo.
I O gás hidrogênio é borbulhado continuamente sobre a superfície do eletrodo a uma pressão de 1,00 atm.
II O potencial de redução do eletrodo padrão de hidrogênio, atribuído por convenção, é zero em qualquer temperatura.
III O metal condutor (Pt) é reduzido pelo hidrogênio atômico, formando um depósito de platina finamente dividida (negro de platina).
IV A reação do eletrodo de hidrogênio é irreversível, ocorrendo sempre no sentido da redução.
Estão corretas APENAS as afirmativas
- A.
I e II.
- B.
I e III.
- C.
I e IV.
- D.
II e III.
- E.
II e IV.

- A.
I e III.
- B.
II e IV.
- C.
III e IV.
- D.
I, II e III.
- E.
I, II e IV.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação CESGRANRIO (CESGRANRIO) - 2011
Considere os seguintes elementos e suas respectivas configurações eletrônicas:
J = [Ne] 3s1
Q = [Kr] 4d10 5s1
X = [Kr] 4d10 5s2 5p2
M = [Xe] 6s1
Sobre esses elementos, considere as afirmativas a seguir.
I A quarta camada do elemento M está completamente preenchida.
II J, Q e M são metais alcalinos.
III X é um metal do grupo do carbono.
IV Q e X são do mesmo período da Tabela Periódica.
Estão corretas APENAS as afirmativas
- A.
I e II.
- B.
I e IV.
- C.
III e IV.
- D.
I, II e III.
- E.
II, III e IV.
O princípio da espectroscopia fotoeletrônica se baseia no efeito fotoelétrico, descoberto no final do século XIX por Heinrich Hertz. Nesse princípio, a incidência de luz na superfície de um metal levava à indução de corrente elétrica. Se um experimento semelhante é realizado no estado gasoso, pode-se medir a energia de ionização de um elemento: o fóton da luz incidente transfere energia para o elétron, que é ejetado. A diferença de energia do fóton e do elétron ejetado é a energia de ionização do elemento. Considere as afirmativas abaixo sobre esses experimentos.
I A energia de cada fóton que incidirá na superfície metálica é independente da intensidade da luz.
II Para que o efeito fotoelétrico seja observado no sódio, necessita-se de um maior comprimento de onda que o utilizado para o potássio.
III O comprimento de onda necessário para que haja o efeito fotoelétrico aumentará com a dificuldade em ejetar os elétrons.
IV Para um mesmo elemento, quanto menor o comprimento de onda da luz incidente, maior será a energia cinética do primeiro elétron ejetado.
Estão corretas APENAS as afirmativas
- A.
I e III.
- B.
I e IV.
- C.
II e III.
- D.
II e IV.
- E.
I, II e IV.

- A.
primeiro nível energético.
- B.
terceiro nível energético.
- C.
quarto nível energético.
- D.
quinto nível energético.
- E.
sexto nível energético.


