Questões de Química do ano 2011
Lista completa de Questões de Química do ano 2011 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
No controle da hiperacidez estomacal pode-se utilizar uma solução de comprimido antiácido contendo carbonato e bicarbonato. Nessa solução encontram-se os equilíbrios representados pelas seguintes equações:
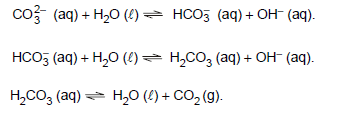
Quando ingerida, essa solução reage com o ácido estomacal e, como consequência, ocorre
- A.
aumento da concentração de íons CO32- (aq).
- B.
desidratação estomacal.
- C.
aumento da concentração de íons H+ (aq).
- D.
liberação de gás.
- E.
diminuição do pH dentro do estômago.
A obtenção do sal da água do mar se dá pela retirada do sal sólido à medida que evapora a água do mar contida em grandes tanques. Nesse processo é obtido sal com teor de mais de 95% em NaCl. Esse alto teor de NaCl é possível porque
- A.
a água do mar tem esse teor de NaCl.
- B.
o NaCl é obtido por cristalização fracionada.
- C.
a temperatura de ebulição da água é maior que a do NaCl.
- D.
a densidade do NaCl é maior que a da água.
- E.
a temperatura de fusão da água é maior que a do NaCl.
Para demonstrar o efeito da superfície de contato e dos catalisadores em uma reação química, pode-se realizar alguns experimentos, como os descritos a seguir:
I. dissolução de um comprimido efervescente em água.
II. decomposição da água oxigenada com dióxido de manganês.
As condições para esses experimentos que demonstram maior rapidez nas reações são:
- A.
comprimido inteiro em I e decomposição na ausência de MnO2em II.
- B.
comprimido triturado em I e decomposição na ausência de MnO2 em II.
- C.
comprimido triturado em I e decomposição na presença de MnO2 em II.
- D.
comprimido inteiro em I e decomposição na presença de MnO2 em II.
- E.
comprimido inteiro em I e decomposição independente do MnO2 em II.
O oxigênio utilizado em hospitais é obtido a partir do ar atmosférico. Nesse processo, o ar é liquefeito para se conseguir a separação de seus componentes, pela destilação fracionada. As condições de temperatura e pressão que permitem a liquefação do ar são
- A.
baixa temperatura e baixa pressão.
- B.
alta temperatura e alta pressão.
- C.
alta temperatura e baixa pressão.
- D.
alta temperatura e pressão atmosférica normal.
- E.
baixa temperatura e alta pressão.
Para demonstrar o processo de tratamento da água de abastecimento público para seus alunos, um professor deve utilizar experimentos que envolvam os seguintes procedimentos, nessa ordem:
- A.
filtração, coagulação e decantação.
- B.
decantação, filtração e coagulação.
- C.
decantação, coagulação e filtração.
- D.
filtração, decantação e coagulação.
- E.
coagulação, decantação e filtração.
Quando se prepara um suco a partir de uma mistura em pó, certamente pode-se desenvolver a articulação da experiência cotidiana com os seguintes conhecimentos químicos:
- A.
modelos atômicos.
- B.
diluição e equilíbrio químico.
- C.
hidrocarbonetos e álcoois.
- D.
dissolução e concentração de soluções.
- E.
partículas constituintes do átomo.
Atenção: Considere os dados abaixo para responder às questões de números 27 e 28.

A liquefação da água está corretamente representada pelo diagrama de energia
- A.

- B.

- C.

- D.

- E.

Atenção: Considere os dados abaixo para responder às questões de números 27 e 28.
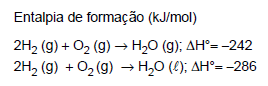
A combustão do GLP (gás liquefeito de petróleo) libera 4,5 × 104 kJ por quilograma de gás. Assim, para vaporizar 1 mol de água (cerca de 18 g) é necessário queimar uma massa, em gramas, desse gás correspondente a, aproximadamente,
- A.
3,29.
- B.
2,50.
- C.
1,58.
- D.
1,23.
- E.
0,98.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação Carlos Chagas (FCC) - 2011
A classificação periódica dos elementos foi idealizada por vários cientistas e, em todas as propostas,
I. procurava-se agrupar os elementos por suas propriedades semelhantes.
II. havia lacunas que seriam preenchidas com a descoberta de novos elementos.
III. considerava-se o número de elétrons de cada elemento.
Está correto o que se afirma APENAS em
- A.
I.
- B.
II.
- C.
III.
- D.
I e II.
- E.
I e II.
A comparação da condução de eletricidade em soluções formadas por água + açúcar e água + sal permite explorar as diferenças dos materiais quanto à
- A.
natureza das ligações químicas.
- B.
solubilidade.
- C.
pressão de vapor.
- D.
volatilidade.
- E.
acidez.


