Questões de Química do ano 2011
Lista completa de Questões de Química do ano 2011 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011

O Ca(ClO)2 apresenta, em sua estrutura, ligações covalentes e ligações metálicas.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011

A molécula de HCRO apresenta geometria linear.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011

Nas mesmas condições de temperatura e pressão, a água de uma piscina tratada com Ca(ClO)2 evapora mais lentamente do que a água pura.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011

A dissolução de 0,010 mol de Ca(ClO)2 em 1,0 L de água pura, à temperatura T, gera uma concentração de equilíbrio de HClO superior a 1,0 × 10 -3 mol/L.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011

A dissolução de 715 g de Ca(ClO)2 em 100.000 L de água pura gera uma solução com concentração analítica de cálcio superior a 2,0 × 10 -5 mol/L.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011

O íon Ca2+ é formado pela adição de dois prótons ao átomo de cálcio.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011

Na reação de hidrólise da água, o íon ClO- atua como uma base de Brønsted-Lowry e também como uma base de Lewis.
- C. Certo
- E. Errado
Grande parte dos efeitos luminosos visualizados durante shows com fogos de artifício é produzida por luminescência. Nesse fenômeno, elétrons são excitados a estados de energia mais elevados e, ao retornarem para estados mais baixos, emitem luz característica de cada espécie química. Por exemplo, sais de Sr2+ emitem radiação vermelha, enquanto sais de Cu2+, radiação azul.
Tendo o fragmento de texto acima como referência inicial, julgue os itens seguintes, a respeito da luminescência e de sua relação com a estrutura eletrônica.
O experimento de bombardeamento de uma fina folha de platina com partículas 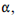 realizado no início do século XX pela equipe de Ernest Rutherford, permitiu explicar a razão de cada espécie química emitir radiação com uma coloração específica.
realizado no início do século XX pela equipe de Ernest Rutherford, permitiu explicar a razão de cada espécie química emitir radiação com uma coloração específica.
- C. Certo
- E. Errado
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011
Grande parte dos efeitos luminosos visualizados durante shows com fogos de artifício é produzida por luminescência. Nesse fenômeno, elétrons são excitados a estados de energia mais elevados e, ao retornarem para estados mais baixos, emitem luz característica de cada espécie química. Por exemplo, sais de Sr2+ emitem radiação vermelha, enquanto sais de Cu2+, radiação azul.
Tendo o fragmento de texto acima como referência inicial, julgue os itens seguintes, a respeito da luminescência e de sua relação com a estrutura eletrônica.
A menor energia que um íon Sr2+ pode emitir ao retornar para o estado fundamental a partir de um estado excitado corresponde à diferença de energia entre os orbitais 4p e 5s.- C. Certo
- E. Errado
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011
A tabela periódica foi desenvolvida a partir da segunda metade do século XIX e permitiu sistematizar os conhecimentos sobre as propriedades dos elementos químicos. Ao longo dos anos, diversas versões foram formuladas, até se chegar ao modelo atual, apresentado ao final desta prova objetiva.
Com relação à estrutura atômica dos elementos químicos, à tabela periódica e à construção dessa tabela, julgue os itens que se seguem.
O flúor apresenta raio atômico menor que o do nitrogênio.
- C. Certo
- E. Errado


