Questões de Química do ano 2011
Lista completa de Questões de Química do ano 2011 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011
Elevadas concentrações de ácido glicólico, substância largamente empregada na composição de produtos cosméticos para tratamento da pele, podem desencadear irritação. A determinação da concentração dessa substância nesses tipos de produtos é feita geralmente por métodos titulométricos, principalmente por meio da volumetria de neutralização com indicadores universais ou por titulação potenciométrica. A respeito desse assunto, julgue os itens seguintes, sabendo que o pKa do ácido glicólico é 3,83.
Constitui importante requisito para que um composto possa ser empregado como padrão primário em métodos volumétricos o fato de sua massa molar ser razoavelmente elevada, para que o erro relativo associado a sua pesagem seja minimizado.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011
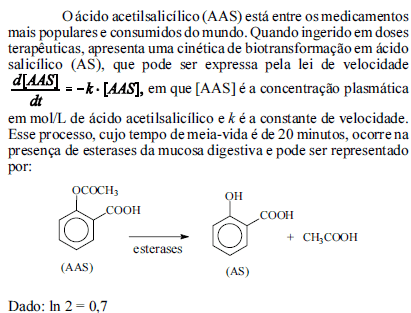
Com base nessas informações, julgue os próximos itens.
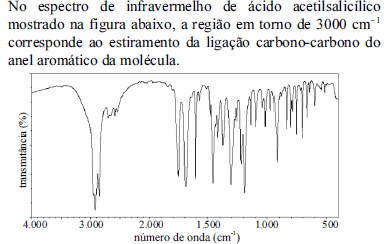
- C. Certo
- E. Errado
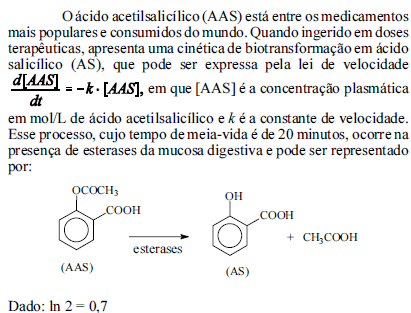
Com base nessas informações, julgue os próximos itens.
A partir da forma integrada da lei de velocidade e do valor do tempo de meia-vida do fármaco no corpo humano, infere-se que a constante cinética do processo de biotransformação mostrado (k) é igual a 0,035 minuto-1.
- C. Certo
- E. Errado
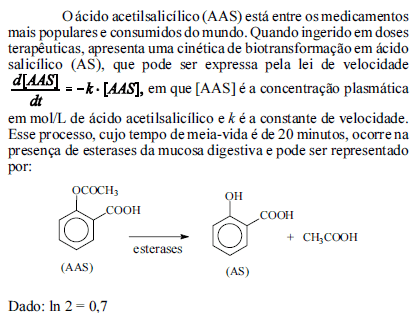
Com base nessas informações, julgue os próximos itens.
De acordo com a análise da expressão da lei de velocidade de biotransformação do AAS, é correto afirmar que se trata de um processo com cinética de primeira ordem.
- C. Certo
- E. Errado
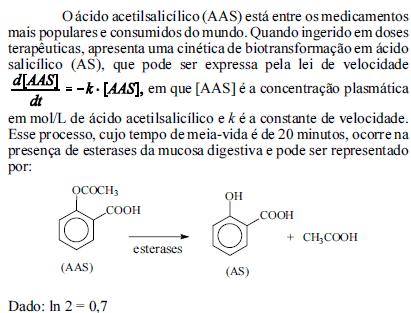
Com base nessas informações, julgue os próximos itens.
Sabendo-se que a eliminação do AAS ocorre principalmente por via renal, sob várias formas, entre as quais se destaca o salicilato livre, é correto afirmar que, considerando-se uma mesma quantidade de AAS metabolizada, a concentração de salicilato livre é maior em urina alcalina que em urina ácida.
- C. Certo
- E. Errado
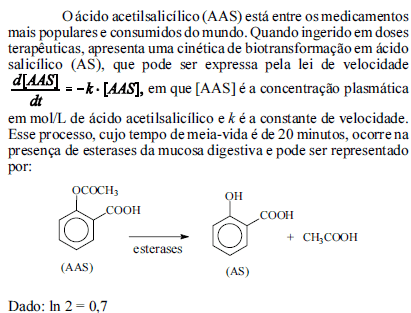
Com base nessas informações, julgue os próximos itens.
De acordo com a equação de Arrhenius, elevação de temperatura implica aumento da taxa de biotransformação do AAS no corpo humano, em consequência da diminuição da energia de ativação do processo.
- C. Certo
- E. Errado
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011
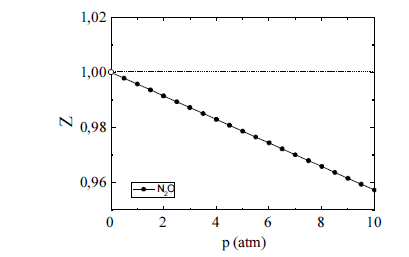
O óxido nitroso (N2O) tem sido amplamente utilizado como agente inalatório para a analgesia e sedação de pacientes submetidos a determinados procedimentos médicos e odontológicos. Na figura acima, é esboçado o gráfico da variação do fator de compressibilidade (Z) desse gás em função da pressão (p), sob temperatura ambiente. A respeito desse gás, julgue os itens seguintes.

- C. Certo
- E. Errado
O óxido nitroso (N2O) tem sido amplamente utilizado como agente inalatório para a analgesia e sedação de pacientes submetidos a determinados procedimentos médicos e odontológicos. Na figura acima, é esboçado o gráfico da variação do fator de compressibilidade (Z) desse gás em função da pressão (p), sob temperatura ambiente. A respeito desse gás, julgue os itens seguintes.
Pelo perfil da dependência do fator de compressibilidade com a pressão para o óxido nitroso, apresentado no gráfico, inferese que as interações intermoleculares repulsivas são predominantes no comportamento do gás, na faixa de valores de pressão em análise.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011
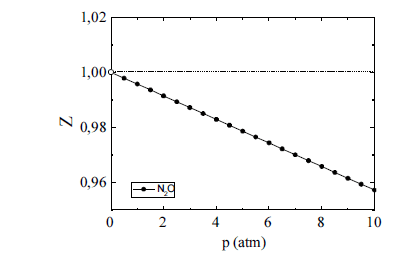
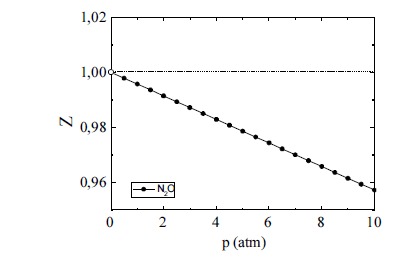
O óxido nitroso (N2O) tem sido amplamente utilizado como agente inalatório para a analgesia e sedação de pacientes submetidos a determinados procedimentos médicos e odontológicos. Na figura acima, é esboçado o gráfico da variação do fator de compressibilidade (Z) desse gás em função da pressão (p), sob temperatura ambiente. A respeito desse gás, julgue os itens seguintes.

- C. Certo
- E. Errado
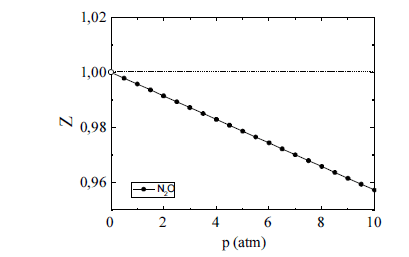
O óxido nitroso (N2O) tem sido amplamente utilizado como agente inalatório para a analgesia e sedação de pacientes submetidos a determinados procedimentos médicos e odontológicos. Na figura acima, é esboçado o gráfico da variação do fator de compressibilidade (Z) desse gás em função da pressão (p), sob temperatura ambiente. A respeito desse gás, julgue os itens seguintes.
Considere que, em um procedimento médico, determinado fluxo de óxido nitroso escoe em uma tubulação previamente evacuada, de modo que o gás sofra uma expansão livre, comportando-se de forma ideal. Em face dessa situação, conclui-se, com base na primeira lei da termodinâmica, que a variação de energia interna do sistema origina-se exclusivamente das trocas de calor do sistema com a vizinhança.
- C. Certo
- E. Errado


