Questões de Química do ano 2012
Lista completa de Questões de Química do ano 2012 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Universidade Federal do Rio de Janeiro (UFRJ) - 2012
O pH da solução resultante da mistura de volumes iguais das soluções de ácido fosfórico (pka1 = 2,14; pKa2 = 7,20 e pKa3 = 12,1) 0,2 moL/L e de hidróxido de sódio 0,1 moL/L, considerando que a reação é completa, é igual a
- A. 2,14.
- B. 7,00.
- C. 7,20.
- D. 12,1.
- E. 13,0.
A dicromatometria é uma técnica amplamente empregada nos laboratórios de ensino e pesquisa para determinar do teor de ferro em minérios através de uma reação de oxirredução entre os íons ferro e os íons dicromato. Nessa determinação, utiliza-se como titulante uma solução de dicromato de potássio e, junto com o titulado, usa-se cloreto estanoso, difenilamina, ácido fosfórico e cloreto de mercúrio (II). A seguir, são feitas algumas afirmações acerca dessa técnica. Assinale a alternativa correta.
- A. Nesta técnica se faz necessário o uso de um indicador redox que é a difenilamina.
- B. O cloreto estanoso tem a função de oxidar os íons Fe+2 a Fe+3, para que a reação aconteça.
- C. C) O cloreto de mercúrio (II) tem a função de reduzir o potencial do sistema Fe+2/Fe+3.
- D. Nesta reação são trocados três elétrons entre os íons ferro e os íons dicromato.
- E. No ponto final desta titulação os íons Cr+3, conferem à solução uma coloração azul.
Química - Reações, Soluções e Transformações Químicas - Universidade Federal do Rio de Janeiro (UFRJ) - 2012
Considerando que todas as reações envolvidas nas misturas abaixo se deslocam completamente na direção de formação dos produtos, qual mistura pode ser classificada como solução tampão?
- A. 25 mL de solução de ácido acético (pka=4,76) 0,2 moL/L com 0,2 g de hidróxido de sódio.
- B. 25 mL de solução de ácido clorídrico 0,2 moL/L com 16 mL de solução de hidróxido de sódio 0,5 moL/L.
- C. 30 mL de solução de cloreto de amônio (pka=9,24) 0,2 moL/L com 15 mL de solução de hidróxido de sódio 0,2 moL/L.
- D. 30 mL de solução de ácido lático (pka=3,85) 0,1 moL/L com 15 mL de solução de hidróxido de sódio 0,2 moL/L
- E. 50 mL de ácido clorídrico 0,1 moL/L com 30 mL de hidróxido de cálcio 0,2 moL/L.
Química - Reações, Soluções e Transformações Químicas - Universidade Federal do Rio de Janeiro (UFRJ) - 2012
Suponha um ácido fraco HA (101 g/mol) cujo sal da sua base conjugada, NaA, seja utilizado contra a acidez estomacal, na forma de pastilhas, contendo cada uma delas 0,025 g de NaA. Considerando que um indivíduo tenha, em seu estômago, 1 mL de suco gástrico com pH 1 e que ele tenha ingerido 2 pastilhas, a porcentagem aproximada de HA produzida neste processo será de
- A. 2,5%.
- B. 20%.
- C. 25%.
- D. 40%.
- E. 50%.
Um laboratório de ensino tem como uma de suas normas de segurança descartar na pia somente soluções neutras. Ao término de uma aula prática, o técnico observou que, em cada uma das doze bancadas, restou um béquer contendo 40 mL de Ca(OH)2 0,2 mol/L. O volume de solução de HNO3 0,3 moL/L a ser usado para neutralizar todo o resíduo desta aula é
- A. 26,7 mL.
- B. 53,3 mL.
- C. 320 mL.
- D. 640 mL.
- E. 960 mL.
Em relação à espectroscopia molecular no ultravioleta-visível é correto, afirmar que
- A. a técnica fornece informações a respeito da estrutura molecular de substâncias com ligações simples.
- B. para a análise de substâncias por espectroscopia na região do ultravioleta, deve-se usar cubeta de vidro.
- C. a lâmpada de tungstênio é a mais usada para emissão de radiação na região do ultravioleta.
- D. de acordo com a lei de Beer, a absorvância é inversamente proporcional à concentração da espécie absorvente.
- E. o processo de absorção na região do ultravioleta envolve transição dos elétrons de valência da molécula.
A cromatografia em fase gasosa (CG) é uma técnica analítica que permite separar e quantificar componentes voláteis de uma mistura. Acerca deste tipo de cromatografia, é correto afirmar que
- A. a fase estacionária pode ser líquida ou sólida, enquanto a fase móvel pode ser líquida ou gás.
- B. a temperatura da coluna é elevada durante a separação para aumentar a capacidade de retenção da fase estacionária.
- C. as colunas capilares apresentam grande diâmetro interno e por isso tem baixa resolução, quando comparada às colunas empacotadas.
- D. a análise quantitativa está baseada no tempo de retenção e na velocidade com que cada componente da mistura atravessa a coluna.
- E. a estabilidade térmica e a volatilidade são pré-requisitos para que as amostras sejam analisadas por CG.
Sobre a cromatografia em camada delgada (CCD) como técnica de separação para os componentes de uma mistura, é correto afirmar que
- A. a CCD pode ser classificada como cromatografia em coluna aberta em relação a sua forma física.
- B. a fase estacionária, na cromatografia de fase normal, é não polar e usa-se um solvente polar.
- C. o parâmetro qualitativo mais importante a ser considerado, na análise por CCD, é o fator de retenção (Rf).
- D. as fases móveis mais utilizadas, na análise por CCD, para a separação de misturas, são celulose e alumina.
- E. a CCD é um método de extração onde a amostra não pode interagir com as duas fases (móvel e estacionária).
- Assinale a alternativa correta que relaciona a aparelhagem, vidraria ou materiais utilizados no laboratório com sua aplicação.
- A. O polarímetro é um instrumento usado para determinação do ponto de fusão de uma amostra.
- B. O almofariz com pistilo, de porcelana ou vidro, é utilizado para pulverizar e triturar sólidos.
- C. As estufas são fornos elétricos utilizados para calcinar amostras em altas temperaturas.
- D. O funil de adição com equalizador de pressão é utilizado para filtração de amostras sólidas.
- E. O extrator Soxhlet é um frasco de porcelana utilizado para extração de líquidos miscíveis.
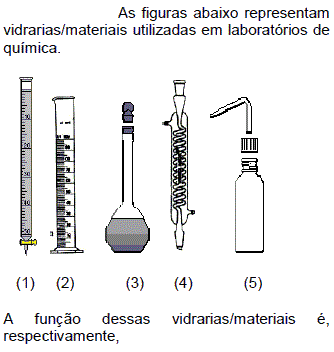
- A. 1 - estocar substâncias líquidas; 2 - medir e transferir volumes de líquidos; 3 - preparar soluções; 4 - titulação e análise volumétrica; 5 - lavagem de materiais.
- B. 1 - titulação e análise volumétrica; 2 - estocar substâncias líquidas; 3 - lavagem de materiais; 4 - condensar vapores; 5 - determinar densidade de líquidos.
- C. 1- determinar densidade de líquidos; 2 - preparar soluções; 3 - estocar substâncias líquidas; 4 - medir e transferir volumes de líquidos; 5 - lavagem de materiais.
- D. 1 - titulação e análise volumétrica; 2 - medir e transferir volumes de líquidos; 3 - preparar soluções; 4- condensar vapores; 5 - lavagem de materiais.
- E. 1 - titulação e análise volumétrica; 2 - preparar soluções; 3 - estocar substâncias líquidas; 4 - medir e transferir volumes de líquidos; 5 - lavagem de materiais.


