Questões de Química do ano 2012
Lista completa de Questões de Química do ano 2012 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2012
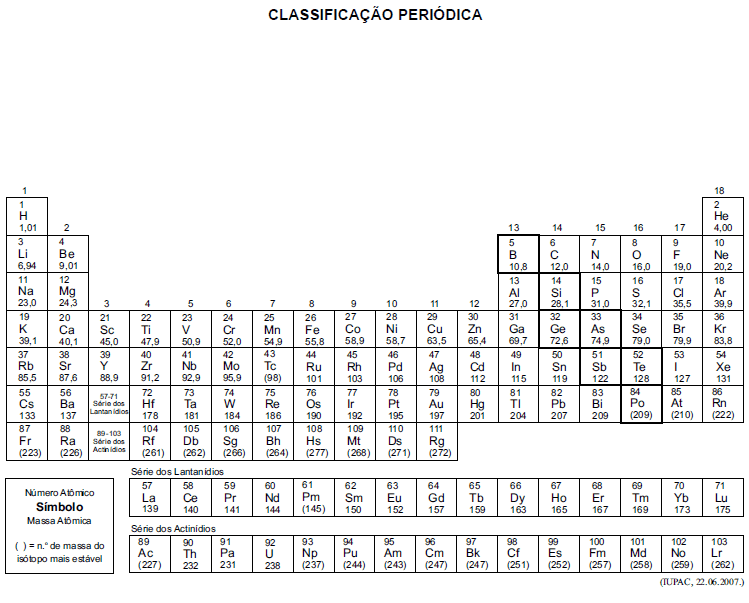
A tabela periódica encontra-se no final deste caderno.
Os minérios de cobre são as fontes naturais do cobre metálico utilizado em fios condutores de eletricidade e de vários compostos de cobre produzidos industrialmente, entre eles, o sulfato de cobre (II), amplamente utilizado como fungicida e algicida no tratamento de águas de reservatórios e na agricultura. Embora a origem seja a mesma, a produção do cobre metálico empregado como condutor elétrico tem custo muito maior do que a do sulfato de cobre (II). Uma das principais razões para essa diferença de custo é o fato de
- A.
os minérios terem como principal constituinte o sulfato de cobre (II).
- B.
a maior parte do sulfato de cobre (II) ser reciclada após o uso.
- C.
a purificação do cobre metálico requerer o consumo de energia elétrica.
- D.
o aumento significativo do número de furtos de fios de redes elétricas.
- E.
o transporte dos minérios ser mais caro quando o destino é a indústria metalúrgica.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2012
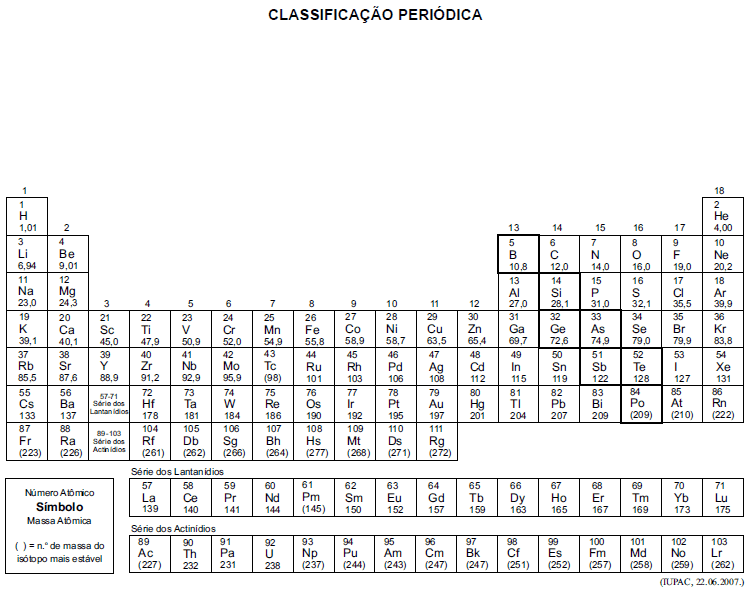
A tabela periódica encontra-se no final deste caderno.
A massa máxima de hidrogênio gasoso, H2 (g), que pode ser obtida pela adição de 1,15 g de sódio metálico a 1 000 g de água líquida é, em gramas, igual a
- A.
0,025.
- B.
0,050.
- C.
0,100.
- D.
2,50.
- E.
5,00.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2012
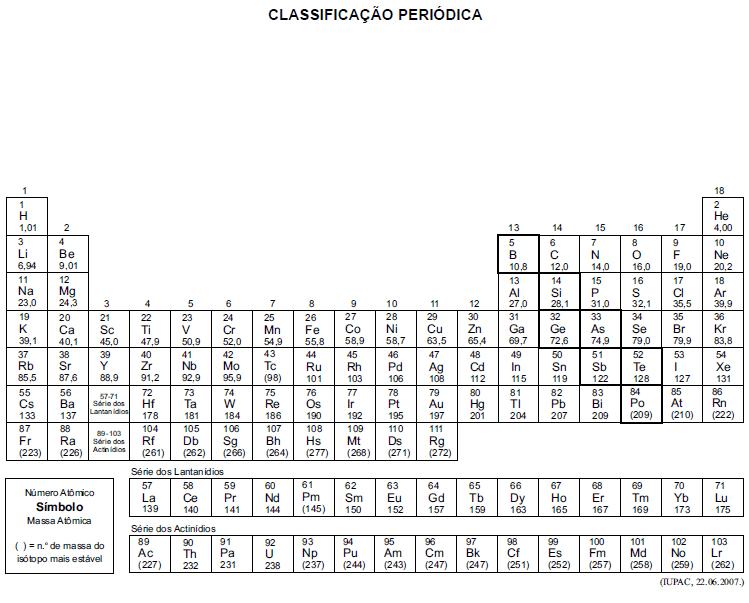
A tabela periódica encontra-se no final deste caderno.

- A.
3 880.
- B.
2 910.
- C.
970.
- D.
+ 1 020.
- E.
+ 6 790.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2012
A tabela periódica encontra-se no final deste caderno.
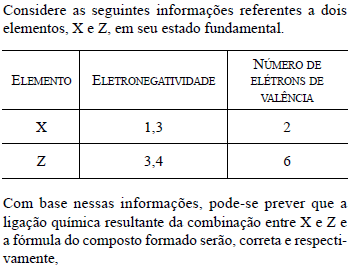
- A.
iônica e XZ.
- B.
iônica e X2Z.
- C.
covalente e XZ.
- D.
covalente e X2Z.
- E.
covalente e XZ2.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2012
A tabela periódica encontra-se no final deste caderno.
Considere as seguintes informações sobre o cloreto de hidrogênio, HCl:
apresenta ponto de fusão igual a 114 ºC e ponto de ebulição igual a 85 ºC, a 1 atm;
quando puro, no estado líquido, conduz muito mal a corrente elétrica;
ao interagir com água líquida, origina solução aquosa que conduz muito bem a corrente elétrica.
Sendo assim, o HCl é um __________ nas condições ambiente. Conduz mal a corrente elétrica no estado líquido, pois a ligação entre os átomos em sua molécula é __________ . Em contato com a água líquida, essas ligações são rompidas, originando __________ hidratados.
As lacunas desse texto são preenchidas, correta e respectivamente, por:
- A.
líquido ... iônica ... íons
- B.
líquido ... covalente ... elétrons
- C.
gás ... iônica ... íons
- D.
gás ... covalente ... elétrons
- E.
gás ... covalente ... íons
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2012
A tabela periódica encontra-se no final deste caderno.
Comparando-se os modelos atômicos de Thomson, Rutherford e Bohr, é possível afirmar que os três permitem justificar
I. a ionização de gases verificada em tubos de descarga sob baixa pressão e alta tensão elétrica.
II. os espectros de emissão luminosa emitidos por diferentes elementos químicos.
III. a presença de nêutrons no núcleo dos átomos.
Está correto o que se afirma apenas em
- A.
I.
- B.
II.
- C.
III.
- D.
I e II.
- E.
II e III.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2012
A tabela periódica encontra-se no final deste caderno.

- A.
0,2.
- B.
0,4.
- C.
0,6.
- D.
0,8.
- E.
1,0.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2012
A tabela periódica encontra-se no final deste caderno.
Considerando 1 mol de cada um dos compostos indicados nas alternativas apresentadas, indique o que requer maior massa de oxigênio, O2 , para sua combustão completa.
- A.
Etano, CH3-CH3.
- B.
Etanol, CH3-CH2OH.
- C.
1,2-etanodiol, CH2(OH)-CH2(OH).
- D.
Etanal, CH3-CHO.
- E.
Ácido etanoico, CH3-COOH.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2012
A tabela periódica encontra-se no final deste caderno.

- A.
das quatro amostras.
- B.
das amostras dos dois cloretos, apenas.
- C.
das amostras dos dois carbonatos, apenas.
- D.
da amostra de carbonato de lítio, apenas.
- E.
da amostra de cloreto de lítio, apenas.
A tabela periódica encontra-se no final deste caderno.

Pode-se obter cal hidratada a partir de cal viva e água pela transformação representada por:
cal viva + água energia → cal hidratada
Por outro lado, pode-se obter cal viva e água a partir da cal hidratada, pela transformação representada por:
cal hidratada + energia → cal viva + água
Examinando-se essas representações, conclui-se que a
I. obtenção de cal hidratada é um processo exoergônico;
II. cal hidratada é uma mistura de substâncias constituída por cal viva e água;
III. obtenção de cal viva e água a partir de cal hidratada é um processo revertível.
Está correto o que se afirma apenas em
- A.
I.
- B.
II.
- C.
III.
- D.
I e III.
- E.
II e III.


