Questões de Química do ano 2013
Lista completa de Questões de Química do ano 2013 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
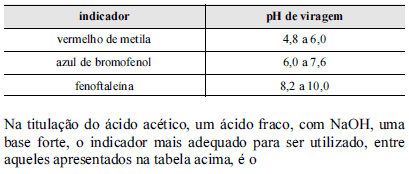
- A.
azul de bromofenol, porque a solução terá pH neutro no ponto de equivalência.
- B.
fenoftaleína, porque a solução terá pH básico no ponto de equivalência.
- C.
fenoftaleína, porque a solução terá pH neutro no ponto de equivalência.
- D.
vermelho de metila, porque a solução terá pH básico no ponto de equivalência.
- E.
vermelho de metila, porque a solução terá pH ácido no ponto de equivalência.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
Considere a titulação de 20,0 mL de uma solução de HCR 0,080 mol/L com uma solução padrão de NaOH 0,10 mol/L. Com relação a esse sistema, é correto afirmar que
- A.
no ponto de equivalência, terá sido gasto um volume da solução de NaOH superior a 20 mL.
- B.
após a adição de 5,0 mL da solução de NaOH, a concentração de íons Na+ na mistura resultante será igual a 0,050 mol/L.
- C.
após a adição de 5,0 mL da solução de NaOH, a concentração de íons H+ na mistura resultante será igual a 0,050 mol/L.
- D.
após a adição de 5,0 mL da solução de NaOH, a concentração de íons Cl- na mistura resultante será igual a 0,064 mol/L.
- E.
no ponto de equivalência, a concentração de íons Na+ será superior à de íons Cl-.
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
Um técnico de laboratório realizou a padronização de 20,0 mL de uma solução de NaOH por meio da titulação com uma solução padrão de HCR 0,10 mol/L.
Considerando que foram gastos, no ponto de equivalência, 18,0 mL da solução ácida, assinale a opção que corresponde à concentração determinada pelo técnico para a solução de NaOH.- A.
0,18 mol/L
- B.
0,20 mol/L
- C.
0,90 mol/L
- D.
0,090 mol/L
- E.
0,10 mol/L
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
Considere que o ácido tereftálico seja um sólido à temperatura ambiente e que sua massa molar seja igual a 166 g/mol. Assinale a opção que apresenta a sequência correta de etapas a ser seguida na preparação de 100 mL de uma solução aquosa padrão 0,10 mol/L do referido ácido.
- A.
pesar 16,6 g do ácido; dissolver o sólido, em um béquer, em uma quantidade de água destilada inferior a 100 mL; transferir quantitativamente a mistura para um balão volumétrico de 100 mL e completar com água destilada
- B.
medir 100 mL de água destilada em um balão volumétrico; verter a água para um béquer; colocar o béquer contendo a água sobre uma balança analítica e adicionar, lentamente, o ácido até que a massa aumente em exatos 16,6 g
- C.
pesar 1,66 g do ácido; medir 100 mL de água destilada em um balão volumétrico; misturá-los em um béquer
- D.
pesar 16,6 g do ácido; medir 100 mL de água destilada em um balão volumétrico; misturá-los em um béquer
- E.
pesar 1,66 g do ácido; dissolver o sólido, em um béquer, em uma quantidade de água destilada inferior a 100 mL; transferir quantitativamente a mistura para um balão volumétrico de 100 mL e completar com água destilada
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
Um laboratorista deseja preparar uma série de padrões para construir uma curva de calibração para a determinação espectrométrica de um fármaco em solução e, para isso, ele dispõe de: a) uma solução padrão com concentração 1,00 × 10-2 mol/L do fármaco; b) pipetas volumétricas de 5,00 mL e de 10,00 mL; e c) balões volumétricos de 500 mL e de 1.000 mL.
Com relação a essa situação hipotética, assinale a opção correta, considerando a utilização exclusiva dos materiais disponíveis.- A.
A solução mais diluída que o laboratorista conseguirá preparar realizando apenas uma pipetagem terá concentração igual a 2,0 × 10-5 mol/L.
- B.
É possível a preparação de uma solução com concentração 1,0 × 10-5 mol/L.
- C.
Com duas pipetagens, a solução mais diluída que pode ser preparada terá concentração 1,0 × 10-7 mol/L.
- D.
Para preparar uma solução com concentração igual a 1,0 × 10-6mol/L, o laboratorista terá que realizar duas pipetagens.
- E.
Realizando apenas uma pipetagem, o laboratorista conseguirá preparar quatro soluções com diferentes concentrações para sua curva.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
O volume Vm de um medicamento, que consiste em uma solução com concentração Cm de determinado princípio ativo, foi adicionado a um volume Vs de uma amostra de soro. A equação mais adequada para calcular a concentração Cf do princípio ativo na mistura obtida é
- A.
Cf = (Vm + Vs) / Vm· Cm
- B.
Cf = Vm· Cm/Vm
- C.
Cf = Vm· Cm/Vm
- D.
Cf = Vm· Cm/(Vm + Vs)
- E.
Cf = Vm· (Vm - Vs) /Cm
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
Considere que o ácido nítrico (HNO3) comercial seja disponibilizado na forma de uma solução aquosa com densidade 1,40 g/mL e concentração 65,0% em massa de HNO3. Nesse caso, o volume dessa solução comercial que deve ser misturado à água na preparação de 1.000 mL de uma solução de HNO3 0,10 mol/L é
- A.
10,3 mL.
- B.
2,4 mL.
- C.
4,6 mL.
- D.
6,9 mL.
- E.
8,8 mL.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
O produto conhecido como álcool 70, usado como desinfetante e antisséptico, é uma solução com concentração 70% em massa de etanol (C2H5OH) em água (H2O). Considerando que as densidades do etanol, da água e do álcool 70 sejam iguais a 0,79 g/cm3, 1,0 g/cm3 e 0,87 g/cm3, respectivamente, julgue as seguintes afirmações.
I O volume molar da água é superior ao do etanol.
II A concentração do álcool 70, quando expressa em termos da porcentagem volume/volume, é superior a 70%.
III A fração molar de etanol no álcool 70 é superior a 0,5.
IV Para preparar 1.000 mL de álcool 70 são necessários mais do que 700 mL de etanol.
V Na preparação de uma solução de álcool 70, a soma dos volumes de água e etanol utilizados é maior do que o volume de solução obtida.
Assinale a opção correta.
- A.
Apenas os itens II e IV estão certos.
- B.
Apenas os itens II, III e IV estão certos.
- C.
Apenas os itens I, III e V estão certos.
- D.
Apenas os itens II, IV e V estão certos.
- E.
Apenas os itens I e II estão certos.
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
Considere que uma solução de soro glicosado contenha 5,4 g de glicose (C6H12O6) a cada 100 mL da solução e que sua densidade seja igual a 1,0 g/mL. Com relação a esse soro, julgue as seguintes afirmações.
I A molalidade é igual a 0,30 mol/kg.
II A concentração comum é igual a 5,4 g/L.
III A concentração molar é igual a 0,30 mol/L.
IV A quantidade de água, em 200 mL de solução, é igual a 200 g.
V A quantidade de glicose, em 200 mL de solução, é igual a 0,060 mol.
Assinale a opção correta.
- A.
Apenas os itens I, III e V estão certos.
- B.
Apenas os itens I e II estão certos.
- C.
Apenas os itens I e III estão certos.
- D.
Apenas os itens III e V estão certos.
- E.
Apenas os itens I, II e IV estão certos.
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
O soro glicosado é uma solução aquosa de glicose. Para separar seus componentes, o processo mais adequado é a
- A.
destilação simples.
- B.
destilação fracionada.
- C.
filtração.
- D.
decantação.
- E.
centrifugação.


