Questões de Química do ano 2014
Lista completa de Questões de Química do ano 2014 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014
Existe grande interesse nas estruturas, propriedades e usos dos compostos de coordenação formados pelos íons metálicos, que agem como ácidos de Lewis, e seus ligantes, que são bases de Lewis, em parte devido à importância biológica dessas espécies químicas. Suas propriedades são fortemente infl uenciadas pelo tipo de ligante e pela geometria. A isomeria também é um fenômeno muito comum entre os compostos de coordenação. Dentre os pares de complexos:
[Cu(NH3)4][PtCl4] e [Pt(NH3)4][CuCl4] [Cr(NH3)6][Fe(CN)6] e [Fe(NH3)6][Cr(CN)6] O tipo de isomeria que ocorre é de:- A. ionização
- B. coordenação
- C. ligação
- D. hidratação
- E. estereoisomeria

- A. 47,4 e 0,92
- B. 9,2 e 47,4
- C. 4,74 e 0,92
- D. 63,5 e 22,4
- E. 6,35 e 2,24
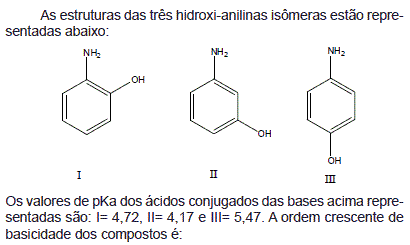
- A. III < II < I
- B. II < III < I
- C. I < III < II
- D. II < I < III
- E. I < II < III
Química - Reações, Soluções e Transformações Químicas - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014
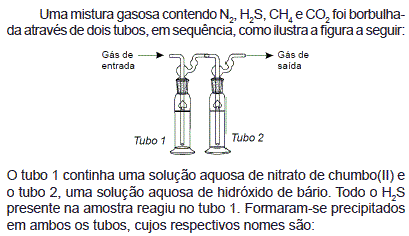
- A. sulfato de chumbo II e carbonato de bário
- B. sulfeto de chumbo II e carbeto de bário
- C. sulfi to de chumbo II e carbonato de bário
- D. sulfeto de chumbo II e carbonato de bário
- E. sulfato de chumbo II e carbeto de bário
Química - Química Inorgânica - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014
Um álcool de fórmula molecular C5H12O, que possui um carbono assimétrico, sofre oxidação com clorocromato de piridínio (PCC formado pela dissolução do óxido de cromo VI em ácido clorídrico e posterior tratamento com piridina), um agente oxidante mais seletivo que o permanganato de potássio (KMnO4) ou o ácido crômico (H2CrO4 - formado pela dissolução do óxido de cromo VI em ácido sulfúrico). O nome ofi cial do produto formado nessa reação é:
- A. ácido 2-metil-butanoico
- B. ácido 3-metil-butanoico
- C. pentan-2-ona
- D. 3-metil-butanal
- E. 2-metil-butanal
Química - Reações, Soluções e Transformações Químicas - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014

- A. aumentar a pressão
- B. aumentar a temperatura
- C. diminuir a pressão
- D. diminuir a temperatura
- E. adicionar catalisador

- A. 17160
- B. 15840
- C. 13220
- D. 16350
- E. 14550
Química - Reações, Soluções e Transformações Químicas - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014
A entalpia padrão de combustão (ΔHC °) de uma substância pode ser determinada experimentalmente em um calorímetro de bomba. Um aparelho desses foi calibrado e sua capacidade calorífi ca determinada foi de 641J.K-1. Ao se promover a queima de 0,64g de glicose (C6H12O6) no calorímetro, nas condições-padrão, a temperatura aumentou de 15,6K. Então, pode-se afi rmar que ΔHC ° da glicose, em kJ.mol-1, é aproximadamente igual a:
- A. +2800
- B. -2800
- C. +1000
- D. -1000
- E. - 3600
Química - Reações, Soluções e Transformações Químicas - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014
O arsênio é um elemento químico muito tóxico que, no estado de oxidação +3, é letal para os humanos em doses de 140mg ou mais. É encontrado principalmente nos minerais arsenopirita, realgar e orpimento, que são sulfetos desse elemento. A reação entre sulfeto de arsênio III, ácido nítrico e água produz ácido sulfúrico, ácido arsênico e óxido nítrico gasoso. Após escrever a equação química completa e balanceada, a soma de todos os menores coefi cientes estequiométricos inteiros é igual a:
- A. 60
- B. 78
- C. 58
- D. 80
- E. 70
Química - Reações, Soluções e Transformações Químicas - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014
A variação de energia livre de Gibbs (ΔG) é uma medida da variação total de entropia de um sistema e suas vizinhanças, à pressão e temperatura constantes e prevê a espontaneidade da ocorrência de um processo, de acordo com a segunda Lei da Termodinâmica. Cinco reações químicas, numeradas por I, II, III, IV e V, cujas variações de entalpia (ΔH) e entropia (ΔS) são conhecidas, devem ser escolhidas para sua realização à mesma temperatura. São mostrados a seguir os dados relativos a cada uma das reações: Reação I - ΔH positivo e ΔS negativo, sendo que o ΔS multiplicado pela temperatura gera um valor numérico menor que o do ΔH. Reação II - ΔH positivo e ΔS positivo, sendo que o ΔS multiplicado pela temperatura gera um valor numérico menor que o de ΔH. Reação III - ΔH positivo e ΔS negativo, sendo que o ΔS multiplicado pela temperatura gera um valor numérico maior que o de ΔH. Reação IV - ΔH negativo e ΔS negativo, sendo que o ΔS multiplicado pela temperatura gera um valor numérico maior que o de ΔH. Reação V - ΔH positivo e ΔS positivo, sendo que o ΔS multiplicado pela temperatura gera um valor numérico maior que o de ΔH. Segundo dados exclusivamente termodinâmicos, a reação a ser escolhida é a de número:
- A. I
- B. II
- C. III
- D. IV
- E. V


