Questões sobre Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica
Lista completa de Questões sobre Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011
Em um sítio arqueológico, foram encontrados ossos de animais e um perito foi incumbido de fazer a datação das ossadas. Sabe-se que a quantidade de carbono 14, após a morte do animal, varia segundo a lei Q(t) = Q(0) e-0,00012t, em que e é a base do logaritmo natural, Q(0) é a quantidade de carbono 14 existente no corpo do animal no instante da morte e Q(t) é a quantidade de carbono 14 t anos depois da morte. Com base nessas informações e considerando -2,4 e 0,05 como valores aproximados de ln (0,09) e e-3, respectivamente, julgue os itens que se seguem.
Suponha que, ao examinar uma ossada, o perito tenha verificado que o animal morreu há 25.000 anos. Nesse caso, a quantidade de carbono 14 existente nessa ossada, no instante do exame, era superior a 4% da quantidade no instante da morte.
- C. Certo
- E. Errado
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011
Grande parte dos efeitos luminosos visualizados durante shows com fogos de artifício é produzida por luminescência. Nesse fenômeno, elétrons são excitados a estados de energia mais elevados e, ao retornarem para estados mais baixos, emitem luz característica de cada espécie química. Por exemplo, sais de Sr2+ emitem radiação vermelha, enquanto sais de Cu2+, radiação azul.
Tendo o fragmento de texto acima como referência inicial, julgue os itens seguintes, a respeito da luminescência e de sua relação com a estrutura eletrônica.
A menor energia que um íon Sr2+ pode emitir ao retornar para o estado fundamental a partir de um estado excitado corresponde à diferença de energia entre os orbitais 4p e 5s.- C. Certo
- E. Errado
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011
A tabela periódica foi desenvolvida a partir da segunda metade do século XIX e permitiu sistematizar os conhecimentos sobre as propriedades dos elementos químicos. Ao longo dos anos, diversas versões foram formuladas, até se chegar ao modelo atual, apresentado ao final desta prova objetiva.
Com relação à estrutura atômica dos elementos químicos, à tabela periódica e à construção dessa tabela, julgue os itens que se seguem.
O flúor apresenta raio atômico menor que o do nitrogênio.
- C. Certo
- E. Errado
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011
A tabela periódica foi desenvolvida a partir da segunda metade do século XIX e permitiu sistematizar os conhecimentos sobre as propriedades dos elementos químicos. Ao longo dos anos, diversas versões foram formuladas, até se chegar ao modelo atual, apresentado ao final desta prova objetiva.
Com relação à estrutura atômica dos elementos químicos, à tabela periódica e à construção dessa tabela, julgue os itens que se seguem.
Todos os elementos de um mesmo grupo da tabela periódica apresentam, na forma não ionizada, o mesmo número de elétrons de valência.
- C. Certo
- E. Errado
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011
A tabela periódica foi desenvolvida a partir da segunda metade do século XIX e permitiu sistematizar os conhecimentos sobre as propriedades dos elementos químicos. Ao longo dos anos, diversas versões foram formuladas, até se chegar ao modelo atual, apresentado ao final desta prova objetiva.
Com relação à estrutura atômica dos elementos químicos, à tabela periódica e à construção dessa tabela, julgue os itens que se seguem.
Nas primeiras versões da tabela periódica, antes da descoberta da massa atômica, o ordenamento dos elementos era feito com base nos números atômicos.
- C. Certo
- E. Errado
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011
A tabela periódica foi desenvolvida a partir da segunda metade do século XIX e permitiu sistematizar os conhecimentos sobre as propriedades dos elementos químicos. Ao longo dos anos, diversas versões foram formuladas, até se chegar ao modelo atual, apresentado ao final desta prova objetiva.
Com relação à estrutura atômica dos elementos químicos, à tabela periódica e à construção dessa tabela, julgue os itens que se seguem.
De acordo com a teoria das ligações de valência, a maior parte dos gases nobres é capaz de formar compostos moleculares, uma vez que podem sofrer expansão da sua camada de valência.
- C. Certo
- E. Errado
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011
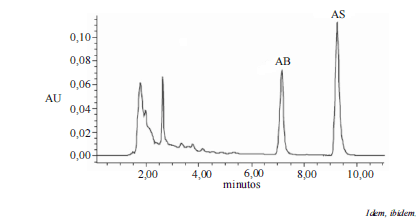
Com base na figura acima, que representa um cromatograma obtido pela técnica de CLAE no caso de uma amostra de vinho tinto e considerando que, como fase estacionária, tenha sido utilizada uma coluna cromatográfica de fase reversa e, como fase móvel, tenha sido empregada, à vazão de 1 mL/min, uma mistura com composição em volume de 81% de água, 17% de acetonitrila e 2% de acetato de amônio 0,005M com pH 4,2 ajustado com ácido acético glacial, tendo sido a detecção efetuada com sistema UV/VIS a 260 nm, julgue os seguintes itens.
Dados os tempos de retenção apresentados no cromatograma, é correto afirmar que o ácido benzoico (AB) é mais polar que o ácido sórbico (AS).
- C. Certo
- E. Errado
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011
Elevadas concentrações de ácido glicólico, substância largamente empregada na composição de produtos cosméticos para tratamento da pele, podem desencadear irritação. A determinação da concentração dessa substância nesses tipos de produtos é feita geralmente por métodos titulométricos, principalmente por meio da volumetria de neutralização com indicadores universais ou por titulação potenciométrica. A respeito desse assunto, julgue os itens seguintes, sabendo que o pKa do ácido glicólico é 3,83.

- C. Certo
- E. Errado
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011
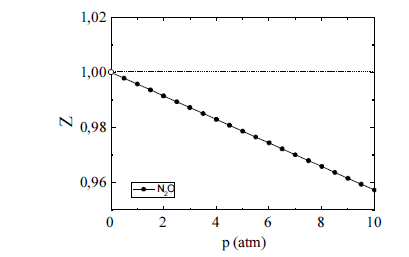
O óxido nitroso (N2O) tem sido amplamente utilizado como agente inalatório para a analgesia e sedação de pacientes submetidos a determinados procedimentos médicos e odontológicos. Na figura acima, é esboçado o gráfico da variação do fator de compressibilidade (Z) desse gás em função da pressão (p), sob temperatura ambiente. A respeito desse gás, julgue os itens seguintes.

- C. Certo
- E. Errado
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação CESGRANRIO (CESGRANRIO) - 2011
Os óxidos são compostos binários nos quais o oxigênio é o elemento mais eletronegativo. Dessa forma, afirma-se que o
- A.
anidrido carbônico representa um óxido ácido.
- B.
óxido de cálcio é um óxido neutro.
- C.
óxido de zinco representa um anidrido.
- D.
óxido de sódio é um óxido anfótero.
- E.
trióxido de enxofre é um óxido básico.


